时间:2025-06-26 00:14:31
1、选择题 下列递变情况正确的是( )
A.Na、Mg、Al最外层电子数依次增多,其还原性依次增强
B.P、S、Cl最高正价依次升高,对应气态氢化物稳定性依次增强
C.C、N、O原子半径依次增大
D.Na和K属于第ⅠA族元素,其氧化物的水化物碱性:NaOH比KOH强
2、填空题 A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的周期序数与族序数相同且A元素原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐M;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。
请回答下列问题:
(1) C和E两种元素相比较,非金属性强的元素在周期表中的位置为?,以下三
种说法中,可以验证C和E非金属性强弱的是(填写编号)?;
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(2) B、D元素所形成化合物的电子式为____________________,B、C、D 元素原子所对应离子半径由大到小的顺序为________________________________;
(3)盐M中含有的化学键类型有?、?;
(4)写出由A、C、D、E四种元素共同形成的两种化合物在水溶液中相互反应的离子方程式为?。
(5)B2A4是一种可燃性液体,B2A4—空气燃料电池是一种碱性燃料电池,B2A4的氧化产物为B2。则负极上的电极反应式为?。
(6)已知1mol D与水反应放出283.5kJ的热量,试写出D与水反应的热化学反应方程式?。
3、填空题 【化学——选修3:物质结构与性质】(15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为____________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________。
| ? | 氟 | 氯 | 溴 | 碘 |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
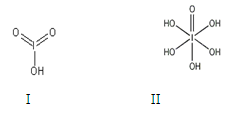
4、填空题 (10分)下表为元素周期表中的一部分.用化学式或元素符号回答下列问题:
| ? | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ? | ? | ? | ⑥ | ? | ⑦ | ? | ? |
| 3 | ① | ③ | ⑤ | ? | ? | ? | ⑧ | ⑩ |
| 4 | ② | ④ | ? | ? | ? | ? | ⑨ | ? |
5、选择题 下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是?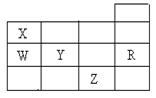 ?
?
A.X、Y、Z的阴离子电子层结构均与R原子的相同
B.常压下,Y单质的沸点比Z单质的沸点高
C.W的氢化物的稳定性比X的氢化物的稳定性强
D.最高价氧化物的水化物酸性W比Y强