时间:2025-06-25 23:30:23
1、填空题 (14分)一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是_______________ ____,
②同体积同物质的量浓度的三种酸,中和NaOH能力的顺序是_________ ________,
③当其c(H+)相同时,物质的量浓度由大到小的顺序为________________ _____,
④当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序为__________________ ___。
⑤当pH相同、体积相同时,同时加入锌,若产生相同体积的氢气(相同状况)则开始时反应速率__________________,反应所需的时间__________ _____ ____。
⑥将c(H+)相同的三种酸均稀释10倍,pH由大到小的顺序为_____________ _______。
2、选择题 水的电离平衡曲线如图所示,下列说法不正确的是
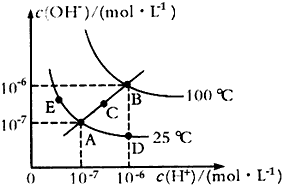
[? ]
3、填空题 (18分)(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)向移动;溶液中 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_____________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多
B.H2A多
C.一样多
D.无法确定
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_______________________________________。
4、填空题 (10分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下
实验。请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液。.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |

5、填空题 (1)某温度下,纯水的[H+] =2.0×l0-7mol·L—l,则此时的[OH—]=__________。若温度不变,滴入稀硫酸使[H+] =5.0×l0-7mol·L—l.则[OH—]=_________,由水电离出的[H+]=__________。
(2)若l00℃时纯水电离出的[H+]为l.0×l0-6mol·L—l,此时Kw=__________。