时间:2025-06-25 23:30:23
1、选择题 下列说法中正确的是
A.已知H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应、稀醋酸与稀NaOH溶液反应所测得的中和热都为ΔH=-57.3kJ/mol
B.由C(石墨,s)= C(金刚石,s)ΔH=+1.9kJ/mol,可知金刚石比石墨稳定
C.在用标准盐酸滴定未知浓度氢氧化钠溶液的实验中,若用待测液润洗锥形瓶,则测定结果偏低(其他操作正确)
D.向存在着FeCl3 (黄色)+3KSCN 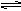 Fe(SCN) 3(血红色) +3KCl平衡体系的溶液中,加少量KCl固体,溶液血红色不发生变化
Fe(SCN) 3(血红色) +3KCl平衡体系的溶液中,加少量KCl固体,溶液血红色不发生变化
参考答案:D
本题解析:中和热不包含离子在溶液中的生热,溶质的溶解热和电解质电离吸收热等伴随的热效应,浓硫酸溶解放热,稀醋酸电离吸热,故所测中和热均不该是ΔH=-57.3kJ/mol,故A错;通过热化学方程式可以看出,反应为吸热反应,石墨的能量低,则石墨比金刚石稳定,故B错误;在滴定实验中,用待测液润洗锥形瓶,只会导致结果偏大,故C错误;铁离子的检验非常敏锐,Fe(SCN) 3浓度变化不足以引起红色的变化,故D正确。
考点:考查中和热和化学平衡相关知识
本题难度:一般
2、填空题 (10分)称取三份锌,分别放入三支试管中,在试管甲里加入PH=3的盐酸50ml,在试管乙里加入PH=3的醋酸50ml,在试管丙里加入PH=3的醋酸50ml及少量铜粉,塞上导管塞子,定时测定生成H2的体积。若反应终了时,生成的H2一样多,且锌没有剩余。
(1)用“>”、“=”或“<”回答以下问题:
①参加反应的锌的质量由多到少的顺序为: 。
②反应完毕时,所需反应时间由多到少的顺序为: 。
(2)简答:
①反应所需时间最长的一种酸的原因是: 。
②乙、丙反应所需时间是否相等?答: 。其原因是: 。
参考答案:(1)①甲=乙=丙 ②甲>乙>丙 (2)①随着反应的进行,盐酸里[H+]减小得最多,反应速率减小最快,时间最长。②不相等,丙中形成了铜锌原电池,加速了锌的反应,丙中反应较乙中快。
本题解析:因为氢气的量相同,所以参加反应的锌的质量相等,故甲=乙=丙;因为丙反应速率最快,其次乙在反应中不停电离,保持较小的pH,而甲pH不断增大,故有:甲>乙>丙。(2)简答:①随着反应的进行,盐酸里[H+]减小得最多,反应速率减小最快,时间最长。因为丙中形成了铜锌原电池,反应速率比单比酸反应要快,加速了锌的反应,丙中反应较乙中快。
考点:化学反应原理及分析PH的变化
点评:高考常考知识之一,化学反应原理及分析溶液的PH的变化,平时对这类题目,要在理解基本概念的前提下,多练习,多总结,才能得心应手。
本题难度:一般
3、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,8 g甲烷中含C-H键的数目为4NA
B.25℃时,1 L pH=13的Ba(OH) 2溶液中含有的OH—数为0.2NA
C.1 mol冰醋酸和1 mol乙醇经催化加热反应生成H2O分子数为NA
D.标准状况下,2.24LCl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA
参考答案:D
本题解析:A、CH4分子含有4个C—H键,8g甲烷物质的量为8g÷16g/mol=0.5mol,所以8 g甲烷中含C-H键的数目为2NA,故A错误;B、pH=13的Ba(OH) 2溶液OH?浓度为:0.1mol?L?1,所以1 L pH=13的Ba(OH) 2溶液中含有的OH—数为0.1NA,故B错误;C、醋酸与乙醇发生的酯化反应是可逆反应,所以1 mol冰醋酸和1 mol乙醇经催化加热反应生成H2O分子数小于NA,故C错误;D、Cl2与稀NaOH溶液反应时,物质的量对应关系为:Cl2~e?,2.24LCl2物质的量为1mol,与稀NaOH溶液反应,转移的电子总数为0.1NA,故D正确。
考点:本题考查阿伏加德罗常数的计算。
本题难度:一般
4、选择题 关于浓度相等的三种溶液:①H2CO3;②NaOH;③Na2CO3溶液,下列说法正确的是:
A.水电离出的c(H+):③>①>②
B.溶液的pH:③>②>①
C.①和②等体积混合后的溶液:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
D.①和③等体积混合后的溶液:c(Na+)+ c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
参考答案:AC
本题解析:A、NaOH为强碱、H2CO3为弱酸,抑制水的电离,浓度相等的NaOH溶液对水的电离抑制程度更大,Na2CO3水解,促进水的电离,所以水电离出的c(H+):③>①>②,正确;B、NaOH为强碱,pH最大,Na2CO3水解显碱性,pH其次,H2CO3为弱酸,pH最小,所以溶液的pH:②>③>①,错误;C、①和②等体积混合后为NaHCO3溶液,根据物料守恒可得:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),正确;D、①和③等体积混合后,根据电荷守恒可得:c(Na+)+ c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),错误。
考点:本题考查水的电离、平衡的判断、物料守恒和电荷守恒。
本题难度:困难
5、选择题 常温下0.01 mol/L NaOH溶液中的c(H+)是0.0005 mol/LBa(OH)2溶液中c(H+)的
[? ]
A.10倍
B.20倍
C.1/10倍
D.1/20倍
参考答案:C
本题解析:
本题难度:一般