时间:2025-06-25 23:30:23
1、选择题 水的电离过程为H2O H++OH-,在25℃时,水的离子积:Kw=1×10-14,在35℃时,水的离子积:
H++OH-,在25℃时,水的离子积:Kw=1×10-14,在35℃时,水的离子积:
Kw(35℃)=2.1×10-14,则下列叙述正确的是
[? ]
A.c(H+)随着温度的升高而降低
B.35℃时,c(H+)<c(OH-)
C.35℃时的水比25℃时的水电离程度小
D.水的电离是吸热的
参考答案:D
本题解析:
本题难度:一般
2、选择题 向浓度为1 mol/L的FeCl2溶液中通入足量的Cl2。下列有关溶液中离子浓度大小关系一定错误的是
A.原FeCl2溶液中:c(Cl-) > c(Fe2+) > c(H+) > c(OH-)
B.原FeCl2溶液中:2c(Fe2+) + c(H+) = c(Cl-) + c(OH-)
C.反应后的溶液中:c(Fe3+) > c(Cl-) > c(H+) > c(OH-)
D.反应后的溶液中:3c(Fe3+) + c(H+) = c(Cl-) + c(OH-)
参考答案:C
本题解析:原溶液被氯气氧化:2FeCl2+Cl2=2FeCl3,得到FeCl3溶液
FeCl2溶液中电荷守恒为:2c(Fe2+) + c(H+) = c(Cl-) + c(OH-),B正确
由于Fe2+部分水解,溶液呈酸性,故c(Cl-) > c(Fe2+) > c(H+) > c(OH-),A正确
FeCl3溶液中电荷守恒为:3c(Fe3+) + c(H+) = c(Cl-) + c(OH-) ,D正确
由于Fe3+部分水解,溶液呈酸性,故c(Cl-) > c(Fe3+) > c(H+) > c(OH-),C不正确
答案为C
本题难度:一般
3、填空题 硫--碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2 +2H2O +I2 =H2SO4 +2HI
Ⅱ.2HI H2 +I2
H2 +I2
Ⅲ.2H2SO4 =2SO2 +O2 +2H2O
(1)分析上述反应,下列判断正确的是_______
a.反应Ⅲ易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。 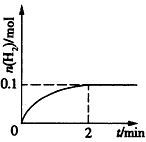
0~2 min内的平均反应速率v(HI)=____。该温度下,H2(g)+I2(g)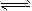 2HI(g)的平衡常数K=____ 相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则____是原来的2倍。
2HI(g)的平衡常数K=____ 相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则____是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡____移动(填“向左”、“向右”或“不”); 若加入少量下列试剂中的____,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
参考答案:(1)c
(2)0.1 mol·L-1·min-1;64;b
(3)向右;b
本题解析:
本题难度:一般
4、选择题 T°C向pH=6的蒸馏水中加入一定量的NaHSO4晶体,保持温度不变,测得溶液的pH=2,下列有关叙述中不正确的是
[? ]
A.T>25℃
B.由水电离出来的c(H+)=1×10-10mol/L
C.c(H+)=c(OH-)+c(SO42-)
D.加入NaHSO4后水的电离程度增大
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列电离方程式错误的是
[? ]
参考答案:D
本题解析:
本题难度:简单