时间:2025-06-25 23:26:18
1、选择题 下列说法不正确的是( )
A.1mol某粒子集体所含该粒子数与0.012kg12C中所含碳原子数相同
B.1mol任何粒子的粒子数叫做阿伏加德罗常数,通常表示为6.02×1023mol-1
C.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
D.常温常压下28g N2所占有的体积大于22.4L
参考答案:C
本题解析:略
本题难度:简单
2、填空题 某气体的摩尔质量为Mg/mol,分子数目为N,质量为mg,阿伏伽德罗常数为NA,试说明下列各式所表示的意义。
(1)N/NA: (2)M/NA:
(3)m/N: 
参考答案:
该气体分子的物质的量 该气体一个分子的质量 该气体一个分子的质量
本题解析:略
本题难度:一般
3、选择题 在标准状况下,将wg A气体(摩尔质量为Mg/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为
[? ]
A.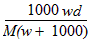 mol/L
mol/L
B.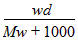 mol/L
mol/L
C.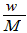 mol/L
mol/L
D.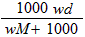 mol/L
mol/L
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列叙述中,错误的是(? )
A.硫酸的摩尔质量是98 g·mol-1
B.2 mol NO和1 mo1 NO2所含的氧元素质量相同
C.等质量的02和03所含氧原子数相等
D.等物质的量的CO和C02所含氧原子数相等
参考答案:D
本题解析:A选项正确,摩尔质量注意带单位。B选项2 mol NO和1 mo1 NO2所含的氧原子都是2mol,所以氧元素的质量相同。C选项等质量说明含有的氧原子的数目相等。但是氧气和臭氧分子数目不相等。D选项中一氧化碳中氧原子的数目为二氧化碳中的一半,错误。
点评:本题考查的物质的量应用都比较简单,考查的是基础的物质的量的计算问题,例如分子数、原子数的计算容易混淆,另外在使用摩尔质量的时候要注意带单位。
本题难度:一般
5、填空题 标准状态下质量比为14:15的N2和NO气体,N2和NO的物质的量之比为______,密度之比为______如将其混合氮原子和氧原子的个数比为______.
参考答案:由质量比为14:15的N2和NO气体,
设N2和NO的质量分别为14g、15g,则
N2和NO的物质的量之比为14g28g/mol:15g30g/mol=1:1,
由pM=ρRT可知,标准状态下气体的密度之比等于摩尔质量之比,
则密度之比等于28g/mol:30g/mol=14:15,
将物质的量之比为1:1的气体混合,
氮原子和氧原子的个数比为(1×2+1):1=3:1,
故答案为:1:1;14:15;3:1.
本题解析:
本题难度:一般