时间:2025-06-25 23:26:18
1、实验题 实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)容量瓶上需标有以下五项中的 ;(3分)
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(2)配制时,其正确的操作顺序是(字母表示) ;(3分)
①用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
②用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
④将容量瓶盖紧,颠倒摇匀
⑤改用胶头滴管加水,使溶液凹面恰好与刻度相切
⑥继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
配制时所需的主要实验仪器有 (5分)
(4)(6分)下列操作对所配溶液浓度会造成什么影响?(填“偏高”、“偏低”或“无影响”)
①用纸称量NaOH固体。 ____________;
②向容量瓶加水定容后摇匀,发现液面低于刻度线,不采取任何措施。___;
③有少量NaOH溶液残留在烧杯内。____________;
④向容量瓶加水时眼睛一直俯视液面。____________;
⑤配制前,容量瓶中有少量蒸馏水。____________;
⑥称量NaOH时,砝码错放在左盘。____________。
参考答案:(1)①③⑤;(2)②③①⑥⑤④。 偏低;无影响;偏低;偏高;无影响;偏低。
本题解析: (1)容量瓶上有使用温度,容量大小,在瓶颈上有一条刻度线。(2)配制溶液的步骤为算、称量、溶解、冷却转移、洗涤、定容、摇匀、装瓶。故答案为:②③①⑥⑤④。(3)配制溶液需要的仪器有250ml容量瓶、烧杯、玻璃棒、胶头滴管、托盘天平、药匙。(4)①用纸称量氢氧化钠固体,因为吸水造成氢氧化钠有损失,故浓度偏低;②定容后,不需要再加水,所以是正确的,无影响;③有氢氧化钠留在烧杯,则容量瓶中的溶质减少,浓度偏低;④俯视会使溶液的体积偏小,则浓度偏高;⑤配制前容量瓶中有水,无影响;⑥因为要称量的氢氧化钠的质量为12.5克,当砝码和药品放反时, 药品的实际质量为11.5克,所以浓度偏低。
考点:一定物质的量浓度的溶液的配制,误差分析。
本题难度:一般
2、选择题 NA为阿佛加德罗常数,下列叙述正确的是
A.22.4LO3 气体含有O3分子数为NA
B.常温常压下,4.6 g NO2气体含有的原子总数为0.3 NA
C.1L 0.5 mol/L CuCl2溶液中含有Cu2+数为0.5 NA
D.标准状况下,33.6 L H2O含有H2O分子数为1.5 NA
参考答案:B
本题解析:A、不正确,应在标准状况下,22.4LO3 气体含有O3分子数才为NA;B、正确,4.6 g NO2气体含有的原子总数为4.6g/46g·mol-1×3?N?A="0.3" NA;?C、不正确,Cu2+水解,溶液中含有Cu2+数少于0.5 NA;D、不正确,标准状况下,水为液体。选B。
考点?:阿佛加德罗常数
本题难度:一般
3、填空题 用20gNaOH配成250mL溶液,它的物质的量浓度为______mol/L.取出5mL该溶液,它的物质的量浓度为______mol/L,再加水稀释至100mL,该100mL溶液可以跟H+浓度为0.1mol/L的硫酸溶液______mL完全中和生成正盐.
参考答案:n(NaOH)=20g40g/mol=0.5mol,
c(NaOH)=0.5mol0.25L=2mol/L,
取出5mL该溶液,它的物质的量浓度不变,仍为2mol/L,其中含n(OH-)=0.005L×2mol/L=0.01mol,
根据反应H++OH-=H2O可知:
n(H+)=n(OH-)=0.01mol,
所以H+浓度为0.1mol/L的硫酸溶液的体积为:V=nc=0.01mol0.1mol/L=0.1L,即100ml,
故答案为:2;2;100.
本题解析:
本题难度:简单
4、填空题 元素周期表是学习和研究化学的重要工具。按要求回答下列问题:
A、B、C、D、E是短周期元素,其原子序数依次增大。A、C两元素的最外层只有一个电子,C离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素A可以和B形成A2B和A2B2两种分子;化合物甲和乙的每个分子中均含有5个原子,甲是由元素D与A组成,其分子的核外电子总数为18,乙是由元素D与E组成;化合物丙是由C与E组成的。
(1)元素B、D、E的元素符号依次为_______、_______、______。
(2)上述5种元素形成的分子中,除甲分子外,核外电子总数也为18的有___(填分子式)
(3)D的氧化物在高温下可以与C的碳酸盐发生反应,其化学反应方程式为________;化合物乙遇水剧烈反应有白雾生成,其反应的化学方程式为___________。
(4)用500mL容量瓶配制400mL 1mol/L的丙溶液,需要丙的质量为________;配制过程中除用到容量瓶外,还需要的玻璃仪器有___________________。电解所配制的400mL溶液,当电路中通过1mol电子时,理论上可收集到的气体在标准状况下的体积为_________L。
参考答案:(1)O,Si,Cl(每空1分)
(2)H2O2、HCl(对一个给1分)?(3)SiO2+Na2CO3 NaSiO3+CO2↑(缺少条件扣1分);
NaSiO3+CO2↑(缺少条件扣1分);
SiCl4+3H2O=H2SiO3+4HCl↑(或SiCl4+4H2O=H3SiO4+4HCl↑)
(4)29.25g(或29.3g),烧杯、玻璃棒、胶头滴管(少1个扣1分,扣完为止);19.04
本题解析:A、B、C、D、E是短周期元素,其原子序数依次增大。A、C两元素的最外层只有一个电子,说明二者是第IA组元素。C离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同。由于非金属性最强的是F,所以C是Na元素。元素A可以和B形成A2B和A2B2两种分子,且B的原子序数小于钠的,因此A和B应该是H和O元素。化合物甲和乙的每个分子中均含有5个原子,甲是由元素D与A组成,其分子的核外电子总数为18,这说明甲是SiH4,所以D是Si元素。乙是由元素D与E组成。由于E的原子序数等于Si的,所以E是氯元素,即乙是SiCl4;化合物丙是由C与E组成的,则丙是NaCl。
(1)元素B、D、E的元素符号依次为O,Si,Cl。
(2)上述5种元素形成的分子中,除甲分子外,核外电子总数也为18的还有H2O2、HCl。
(3)在高温下二氧化硅与碳酸钠反应生成硅酸钠和CO2,反应的化学方程式为SiO2+Na2CO3 NaSiO3+CO2↑。SiCl4遇水剧烈反应有白雾生成,这说明反应中有氯化氢生成。根据原子守恒可知同时还有硅酸生成,则其反应的化学方程式为SiCl4+3H2O=H2SiO3+4HCl↑(或SiCl4+4H2O=H3SiO4+4HCl↑)。
NaSiO3+CO2↑。SiCl4遇水剧烈反应有白雾生成,这说明反应中有氯化氢生成。根据原子守恒可知同时还有硅酸生成,则其反应的化学方程式为SiCl4+3H2O=H2SiO3+4HCl↑(或SiCl4+4H2O=H3SiO4+4HCl↑)。
(4)用500mL容量瓶配制400mL 1mol/L的丙溶液,需要丙的质量=0.5L×1mol/L×58.5g/mol=29.25g;配制过程中除用到容量瓶外,还需要的玻璃仪器有烧杯、玻璃棒和胶头滴管。400mL 1mol/L的氯化钠溶液中溶质氯化钠的物质的量=0.4L×1mol/L=0.4mol。电解氯化钠溶液的方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。根据方程式可知,每生成1mol氢气和1mol氯气转移2mol电子,消耗2mol氢氧化钠,因此0.4mol氢氧化钠转移0.4mol。由于电路中通过1mol电子,这说明氢氧化钠不足,生成氢气和氯气的物质的量都是0.2mol。电解的后阶段只电解水,转移0.6mol电子。则根据方程式2H2O
2NaOH+H2↑+Cl2↑。根据方程式可知,每生成1mol氢气和1mol氯气转移2mol电子,消耗2mol氢氧化钠,因此0.4mol氢氧化钠转移0.4mol。由于电路中通过1mol电子,这说明氢氧化钠不足,生成氢气和氯气的物质的量都是0.2mol。电解的后阶段只电解水,转移0.6mol电子。则根据方程式2H2O 2H2↑+O2↑可知,转移0.6mol电子时生成0.3mol氢气和0.15mol氧气,所以理论上可收集到的气体在标准状况下的体积为(0.2mol+0.2mol+0.3mol+0.15mol)×22.4L/mol=19.04L。
2H2↑+O2↑可知,转移0.6mol电子时生成0.3mol氢气和0.15mol氧气,所以理论上可收集到的气体在标准状况下的体积为(0.2mol+0.2mol+0.3mol+0.15mol)×22.4L/mol=19.04L。
本题难度:一般
5、实验题 (12分)(1)下列每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来.
①NaCl、KCl、NaClO、BaCl2 ??②浊液、溶液、胶体、水?
(2)用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 ml 0.5 mol/L的稀H2SO4,所需浓H2SO4的体积为________ml(小数点后保留一位有效数字),如果实验室有10 ml、20 ml、50 ml量筒,应选用?ml量筒,实验中还需要用到的仪器有?,若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷却至室温即转移至容量瓶进行定容________②定容时仰视刻度线?
③量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2-3次,将洗涤液倒入烧杯?
(3)7.8g的镁铝合金与足量的稀盐酸反应,生成氢气的体积为8.96L(标准状况),则此反应中转移电子的个数为________________,由镁和铝分别产生的氢气的体积之比为________________
(4)取100ml的Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成0.896L(标况)CO2;若向原混合溶液中加入足量的Ba(OH)2溶液,得到沉淀的质量为10.21g,试计算混合溶液中Na2CO3的物质的量浓度是___________mol/L, Na2SO4的物质的量浓度是___________mol/L。
参考答案:(1)①NaClO?②水(2)13.6 mL ;? 20;?烧杯、玻璃棒、胶头滴管、500 mL容量瓶
①偏高?②偏低③偏高(3)4.816×1023?1∶3 (4)Na2CO3?0.4 mol/L? Na2SO4?0.1 mol/L
本题解析:(1)①NaClO是含氧酸盐,其余都是无氧酸盐。
②水是纯净物,其余都是混合物。
(2)500 ml 0.5 mol/L的稀H2SO4中溶质的物质的量是0.25mol,质量是24.5g。所以需要浓硫酸的体积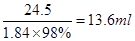 ;量取13.6ml浓硫酸,所需要量筒的规格应该大于13.6mol,且和13.6ml越接近,误差越小,所以选择20ml的量筒;配制一定物质的量浓度溶液的实验中需要的仪器是烧杯、玻璃棒、胶头滴管、500 mL容量瓶;根据c=n/V可知,①未冷却至室温即转移至容量瓶,则冷却后容量瓶中溶液的体积偏小,浓度偏高;②定容时仰视刻度线,则容量瓶中溶液的体积偏多,浓度偏小;③如果洗涤量筒并将洗涤液注入容量瓶中,则溶质的物质的量偏多,浓度偏高。
;量取13.6ml浓硫酸,所需要量筒的规格应该大于13.6mol,且和13.6ml越接近,误差越小,所以选择20ml的量筒;配制一定物质的量浓度溶液的实验中需要的仪器是烧杯、玻璃棒、胶头滴管、500 mL容量瓶;根据c=n/V可知,①未冷却至室温即转移至容量瓶,则冷却后容量瓶中溶液的体积偏小,浓度偏高;②定容时仰视刻度线,则容量瓶中溶液的体积偏多,浓度偏小;③如果洗涤量筒并将洗涤液注入容量瓶中,则溶质的物质的量偏多,浓度偏高。
(3)标准状况下8.96L氢气是0.4mol,转移电子是0.8mol,数目是0.8×6.02×1023 =4.816×1023 ;设镁和铝的物质的量分别是x、y,则24x+27y=7.8g、x+1.5y=0.4,解得x︰y=1∶3。
(4)0.896L(标况)CO2是0.04mol,所以根据碳原子守恒可知,碳酸钠是0.04mol,浓度是0.4mol/L;碳酸钠生成的白色沉淀是0.04mol,质量是7.88g,则硫酸钡的质量是2.33g,物质的量是0.01mol,所以硫酸钠的物质的量也是0.01mol,浓度是0.1mol/L。
本题难度:简单