时间:2025-06-25 22:34:50
1、选择题 制备金属氯化物,常用两种方法:①用金属与氯气直接化合得到;②用金属与盐酸反应制得。下列氯化物中既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是(?)
A.CuCl2
B.FeCl3
C.AlCl3
D.FeCl2
参考答案:C
本题解析:铜与盐酸不反应,不能用两者制氯化铜;铁与盐酸反应得到氯化亚铁,铁与氯气反应得到氯化铁;故符合要求的只有氯化铝,答案选C。
本题难度:一般
2、选择题 下列说法错误的是( )
A.钠和铁一样,都能在氯气中燃烧生成金属氯化物
B.液氯是氯气的水溶液,它能使干燥的有色布条褪色
C.氯气跟变价金属反应生成高价金属氯化物
D.氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸
参考答案:A.钠和铁一样,都能在氯气中燃烧生成金属氯化物,故A正确;
B.液氯是液态的氯气,氯气无漂白性,不能使干燥的有色布条褪色,故B错误;
C.氯气具有强氧化性,跟变价金属反应生成高价金属氯化物,故C正确;
D.氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸,故D正确;
故选B.
本题解析:
本题难度:一般
3、实验题 氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。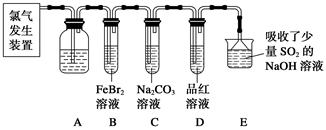
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有__________________。
(2)装置A中盛有的试剂是________,作用是___________________________________。
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是________________。
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是__________(填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32—和SO42—,对于可能存在的其他阴离子,研究小组提出以下3种假设。假设1:只存在SO32—;假设2:只存在ClO-;假设3:既不存在SO32—,也不存在ClO-。
(5)学习小组判断同时存在SO32—和ClO-是不可能的理由是_____________________。
(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol·L-1 H2SO4? b.0.01 mol·L-1 KMnO4
c.1 mol·L-1 BaCl2溶液? d.淀粉碘化钾溶液
e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈中性,然后将所得溶液分装于A、B两试管中。
步骤二:向A试管中滴加少量__________(填序号),若溶液____________________(填现象),则假设1成立。
步骤三:向B试管中滴加少量__________(填序号),若溶液____________________(填现象),则假设2成立。
参考答案:(1)分液漏斗、酒精灯
(2)饱和食盐水 除去氯气中的氯化氢
(3)2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
(4)实验后,取少量B中溶液,滴加KSCN溶液;另取少量B中溶液,加入CCl4溶液萃取
(5)SO32—和ClO-因发生氧化还原反应,故不能存在
(6)b 褪色 d 变蓝色
本题解析:(1)实验室用MnO2和浓盐酸反应制Cl2,用到玻璃仪器除圆底烧瓶和导管外,还用到酒精灯和分液漏斗。
(2)装置A是除杂装置,应用饱和食盐水除去Cl2中的HCl。
(3)Cl2能把FeBr2氧化,离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-。
(4)因为Fe2+被氧化成Fe3+,可用KSCN检验是否存在Fe3+。
(5)因为SO32—和ClO-之间发生氧化还原反应而不能大量共存。
(6)利用SO32—的还原性检验其是否存在,可选用KMnO4溶液;观察是否褪色。检验
ClO-是否存在,可利用其强氧化性,可选用淀粉碘化钾溶液,观察是否变蓝。
本题难度:困难
4、实验题 下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。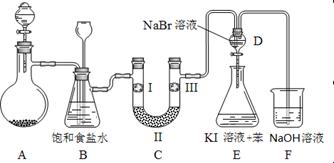
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的离子反应方程式为?;
装置B中饱和食盐水的作用是_________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象?;
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入?;
| ? | a | b | c | d |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
参考答案:(1)MnO2+4H++2Cl? Mn2++Cl2↑+ 2H2O(2分);
Mn2++Cl2↑+ 2H2O(2分);
除去Cl2中的HCl(1分);? B中长颈漏斗中液面上升,形成水柱(2分);
(2)d(2分);
(3)黄(1分);氯气的氧化性强于溴 (2分)? E中溶液分为两层,上层(苯层)为紫红色(2分);
(4)2OH—+Cl2=Cl—+ClO—+H2O(2分)
本题解析:(1)由化学方程式改写可得离子方程式;饱和食盐水可吸收HCl,装置B中饱和食盐水的作用是除去Cl2中的HCl;若装置C堵塞,B中压强增大,长颈漏斗中液面会上升,形成水柱。
(2)装置C的实验目的是验证氯气是否具有漂白性,要验证干燥氯气无漂白性可用湿润的有色布条,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d。
(3)当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为黄色,说明氯气和溴化钠反应生成溴单质,发生反应Cl2+2NaBr=Br2+2NaCl,反应中氯气是氧化剂,溴使氧化产物,故氧化性Br2<Cl2。打开活塞,将装置D中含溴单质的少量溶液加入焓碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡.观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色。
(4)Cl2与NaOH反应生成NaCl、NaClO、H2O,改写可得离子方程式。
本题难度:一般
5、选择题 下列关于氯气的描述不正确的是( )
A.黄绿色
B.有刺激性气味
C.无毒
D.可用排饱和食盐水法收集
参考答案:氯气是黄绿色的气体、氯气有毒、并有刺激性气味、密度比空气大、熔沸点较低、能溶于水易溶于有机溶剂,1体积水在常温下可溶解2体积氯气,难溶于饱和食盐水,可用排饱和食盐水法收集或向下排空法收集,
故选C.
本题解析:
本题难度:一般