时间:2025-06-25 22:34:50
1、选择题 制备金属氯化物,常用两种方法:①用金属与氯气直接化合得到;②用金属与盐酸反应制得。下列氯化物中既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是(?)
A.CuCl2
B.FeCl3
C.AlCl3
D.FeCl2
2、选择题 下列说法错误的是( )
A.钠和铁一样,都能在氯气中燃烧生成金属氯化物
B.液氯是氯气的水溶液,它能使干燥的有色布条褪色
C.氯气跟变价金属反应生成高价金属氯化物
D.氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸
3、实验题 氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。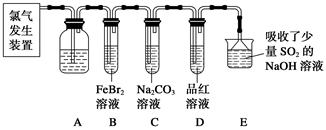
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有__________________。
(2)装置A中盛有的试剂是________,作用是___________________________________。
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是________________。
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是__________(填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32—和SO42—,对于可能存在的其他阴离子,研究小组提出以下3种假设。假设1:只存在SO32—;假设2:只存在ClO-;假设3:既不存在SO32—,也不存在ClO-。
(5)学习小组判断同时存在SO32—和ClO-是不可能的理由是_____________________。
(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol·L-1 H2SO4? b.0.01 mol·L-1 KMnO4
c.1 mol·L-1 BaCl2溶液? d.淀粉碘化钾溶液
e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈中性,然后将所得溶液分装于A、B两试管中。
步骤二:向A试管中滴加少量__________(填序号),若溶液____________________(填现象),则假设1成立。
步骤三:向B试管中滴加少量__________(填序号),若溶液____________________(填现象),则假设2成立。
4、实验题 下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。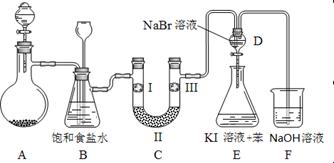
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的离子反应方程式为?;
装置B中饱和食盐水的作用是_________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象?;
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入?;
| ? | a | b | c | d |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
5、选择题 下列关于氯气的描述不正确的是( )
A.黄绿色
B.有刺激性气味
C.无毒
D.可用排饱和食盐水法收集