时间:2025-06-25 22:34:50
1、填空题 (8分)2009年9月27日,热带风暴“凯萨娜”和“芭玛”造成菲律宾多个省份发生大面积洪灾和山体滑坡,超过500人死亡。洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)用化学反应方程式表示工业上制取漂白粉的原理? ?;
?;
(2)漂白粉的成分是(填化学式)?;
(3)漂白粉溶于水后,受空气中的CO2作用,即有漂白、杀菌作用,化学反应方程式为??。
参考答案: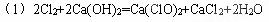
本题解析:略
本题难度:一般
2、选择题 下列说法正确的是(?)
A.非金属元素R所形成的含氧酸盐(NaROb)中的R元素必定呈现正价
B.只有非金属能形成含氧酸或含氧酸盐
C.除稀有气体外的非金属元素都能生成不同价态的含氧酸
D.非金属的最高价含氧酸都具有强氧化性
参考答案:A
本题解析:A. 在任何化合物中正负化合价的代数和为0.因为O的化合价是负价,Na的化合价为+1价,所以非金属元素R所形成的含氧酸盐(NaROb)中的R元素必定呈现正价。正确。B.非金属和金属元素都可以形成含氧酸或含氧酸盐。如H2CO3、Na2CO3;HMnO4、KMnO4等。错误。C. 有些非金属元素如O、F由于非金属性很强,不能生成不同价态的含氧酸。错误。D.不是所有的非金属的最高价含氧酸都具有强氧化性。如H2CO3、H3PO4无强氧化性。错误。
本题难度:一般
3、选择题 下列关于氯元素的说法正确的是( )
A.因1735Cl、1737Cl为不同的核素,因此具有不同的化学性质
B.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
C.11.2LCl2含有17NA个质子(NA表示阿伏伽德罗常数)
D.实验室制备Cl2,可用排饱和食盐水集气法收集
参考答案:A.因1735Cl、1737Cl是同位素,它们的化学性质相似,故A错误;
B.Cl2的化合价可由0价降低为-1价,也可由0价升高为+1价、+3价、+5价,所以Cl2既有氧化性又有还原性,故B错误;
C.根据n=V22.4L/mol的适用范围是标况下的气体,而题目没有指明标况,所以11.2LCl2的体积无法求出物质的量,故C错误;
D.因Cl2不溶于饱和食盐水,可用排饱和食盐水集气法收集,故D正确;
故选D.
本题解析:
本题难度:一般
4、选择题 下列关于新制氯水和久置氯水的说法中不正确的是( )
A.新制氯水呈黄绿色,久置氯水无色
B.新制氯水漂白能力强,而久置的氯水几乎无漂白作用
C.新制的氯水所含微粒种类多,而久置氯水所含微粒种类少
D.新制的氯水中无氯离子,而久置的氯水中则含有氯离子
参考答案:A.因新制氯水中含氯气,所以新制氯水呈黄绿色,久置氯水中无氯气分子,所以呈现无色,故A正确;
B.新制氯水中含次氯酸,次氯酸具有强氧化性,具有漂白作用,久置氯水中无次氯酸,无漂白作用,故B正确;
C.新制氯水中存在的微粒:三分子:Cl2、HClO、H2O,四离子:H+、Cl-、ClO-、OH-,久置氯水含有H2O、H+、Cl-、OH-,故C正确;
D.新制氯水和久置氯水都含氯离子,故D错误.
故选D.
本题解析:
本题难度:简单
5、选择题 海水是巨大的资源宝库,下列关于海水综合利用的说法错误的是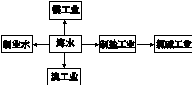
A.海水制淡水主要有蒸馏法、电渗析法、离子交换法等
B.海水制盐、发展氯碱工业都是发生物理变化
C.海水提溴过程中先通入Cl2将溴离子氧化为溴单质
D.工业上用电解熔融MgCl2的方法制取金属镁
参考答案:B
本题解析:A、海水制淡水主要有蒸馏法、电渗析法、离子交换法等,正确;B、海水制盐是物理变化,但发展氯碱工业是电解饱和食盐水,产生了新物质有氯气、氢气单质、氢氧化钠生成,发生化学变化,错误;C、海水中的溴元素以溴离子形式存在,所以海水提溴过程中先通入Cl2将溴离子氧化为溴单质,再将溴吹出,正确;D、氧化镁的熔点较高,所以工业上用电解熔融MgCl2的方法制取金属镁,正确,答案选B。
本题难度:一般