时间:2025-06-25 22:26:46
1、选择题 下列图式表示的是石墨、氯化钠、干冰、金刚石四种晶体中微粒的排列方式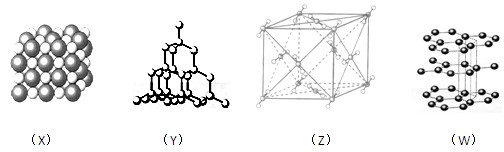
则这四种物质中对应熔点最低的排列方式是
A.X
B.Y
C.Z
D.W
参考答案:C
本题解析:熔点最低的是干冰,干冰是分子晶体,答案选C。
本题难度:一般
2、填空题 下表为长式周期表的一部分,其中的序号代表对应的元素。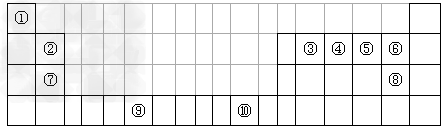
(1)写出上表中元素⑨原子的外围电子排布式__________。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为__________杂化;元素⑦与⑧形成的化合物的晶体类型是__________。
(3)元素④的第一电离能__________元素⑤(填写“>”“=”或“<”)的第一电离能;元素④与元素①形成的X分子的空间构型为__________。请写出与元素④的单质互为等电子体分子、离子的化学式__________(各写一种)。
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________。
(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为 __________。
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为__________;元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________。 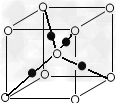
参考答案:(1)3d54s1
(2)sp2;?离子晶体?
(3)>?;?三角锥形;?CO,?C22-
(4)HF气态时会形成(HF)n分子(或HF分子间会形成氢键)
(5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O?
(6)Cu2+ +4NH3=[Cu(NH3)4]2+?或 Cu2+ +2OH-=Cu(OH)2↓? ,Cu(OH)2?+4NH3=[Cu(NH3)4]2++OH-? ;?2
本题解析:
本题难度:一般
3、选择题 下列说法中正确的是(? )
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电扬的作用下金属产生自由电子,电子定向运动
C.分子晶体的熔沸点低,常温下均呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
参考答案:D
本题解析:不同的离子晶体有不同的结构,例如CsCl晶体,每个Cl-周围吸引着8个Cs+,每个Cs+周围有8个Cl-,故A不正确;金属晶体本身就是由金属阳离子和自由电子组成,B不正确;分子晶体中有很多在常温下呈固态,例如I2、S、P4等,故C不正确;原子晶体都以共价键相结合,综上所述,只有D正确。
本题难度:一般
4、选择题 NaCl的晶胞如下图,每个NaCl晶胞中含有的Na+离子和Cl-离子的数目分别是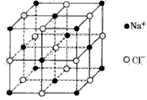
[? ]
A.14 ,13
B.1,1
C.4 ,4
D.6,6
参考答案:C
本题解析:
本题难度:一般
5、填空题 [物质结构与性质](15分)
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| ? | ② | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ③ | ④ | ⑤ | ⑥ | ? |
| ? | ⑦ | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ⑧ | ? |
| ? | ? | ? | ? | ? | ⑨ | ? | ? | ? | ? | ⑩ | ? | ? | ? | ? | ? | ? | ? |
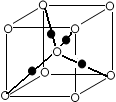
参考答案:(1)3d54s1;(2)sp2;离子晶体;(3)>;三角锥形;CO;CN-(其他合理答案);(4)HF气态时会形成(HF)n分子(或HF分子间会形成氢键)(5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O;(6)Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;2
本题解析:根据题意可知:①是H;②是Be;③是C;④是N;⑤是O;⑥是F;⑦是Mg;⑧是Cl;⑨是Cr;⑩是Cu。(1)根据元素在周期表中的位置可知:上表中元素⑨是Cr,其原子的外围电子排布式3d54s1;(2)在元素③C元素与①H元素形成的水果催熟剂气体化合物C2H4中,元素③的杂化方式为sp2;元素⑦与⑧形成的化合物MgCl2的晶体类型是离子晶体;(3)元素④的第一电离能大于⑤的第一电离能,原因是N原子核外的电子处于该原子轨道的半充满的稳定状态。元素④与元素①形成的最简单的X分子NH3的空间构型为三角锥形;与元素④的单质互为等电子体分子是CO、离子的化学式是CN-;(4)在测定元素①与⑥形成化合物HF的相对分子质量时,实验测得的值一般高于理论值的主要原因是在HF分子之间存在氢键,使分子一几个分子聚合在一起以聚合分子(HF)n的形式存在,(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,根据元素的原子结构及氧化还原反应中的电子守恒可知该反应的化学方程式为4Mg+10HNO3= 4Mg(NO3)2+ NH4NO3+ 3H2O;(6)将过量的NH3通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为Cu2++2NH3·H2O= Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;根据元素⑩的某种氧化物的晶体结构所示,可知:在一个晶胞中含有Cu:4;含有O:8×1/8+1=2则一个晶胞中所包含的氧原子数目为2个。
本题难度:一般