时间:2025-06-25 22:26:46
1、填空题 由两种短周期元素组成的A、B、C、D化合物分子,均含有18个电子,它们分子中所含原子的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。请回答下列问题:?
(1)B、C、D分子中相对原子质量较大的三种元素第一电离能由大到小排列的顺序为___________________(用元素符号回答)。
(2)A与HF相比,其熔、沸点较低,原因是________________________。
(3)B分子的空间构型为________?形,该分子属于__________分子。(填“极性”或“非极性”)
(4)C为一种绿色氧化剂,有广泛应用。请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式__________________,该反应中反应物Cu原子的基态电子排布式为____________。下图是铜晶体一个晶胞的示意图,该晶胞含_________个铜原子。 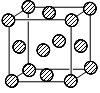
(5)D分子中心原子的杂化方式是_____________,由该原子组成的双原子单质分子中包含_______个π键,与该单质分子互为等电子体的常见分子的分子式为_______________。
参考答案:(1)N>O>S
(2)HF分子间形成氢键
(3)V形(或角形);极性分子
(4)Cu+2H++H2O2=Cu2++2H2O;[Ar]3d104s1;4
(5)sp3;2;CO
本题解析:
本题难度:一般
2、选择题 有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
参考答案:B
本题解析:A分子间作用力只决定其物理性质,稳定性是化学性质的表现,错误;冰熔化时破坏氢键和分子间作用力,错误;氯化钠熔化时破坏离子键,错误;
本题难度:一般
3、选择题 石墨晶体中不存在的化学作用力是( )
A.共价键
B.氢键
C.金属键
D.范德华力
参考答案:B
本题解析:石墨是一种混合型晶体。石墨晶体中,同一层里面的碳原子之间以共价键相互结合,层与层之间是范德华力,石墨中的碳原子采取的是sp2杂化,每一个碳原上都有一个2p轨道与平面垂直,p电子可以在同一层中自由移动。只有氢键不存在,所以应该选择B项。
本题难度:简单
4、选择题 制取晶体的方法中,不正确的是
[? ]
A.熔融态物质凝固
B.气态物质冷却不经过液态直接凝固(凝华)
C.溶质从溶液中析出
D.萃取、分液
参考答案:D
本题解析:
本题难度:简单
5、选择题 同组物质中化学键类型相同、晶体类型也相同的是
A.Ar 、N2、 Si
B.金刚石、 O2、F2
C.Ba(OH)2、K2O 、CaCl2
D.NH3、CO2、CH4
参考答案:D
本题解析:略
本题难度:简单