时间:2025-06-25 22:19:26
1、选择题 酸和碱恰好完全中和时,它们起反应的?一定相等:
A.质量
B.物质的量
C.物质的量浓度
D.H+和OH―的物质的量
参考答案:D
本题解析:酸碱恰好完全中和时,其本质就是它们起反应的H+和OH―的物质的量刚好完全相等,故答案选D。
点评:本题关键在于如何很好的理解酸和碱恰好完全中和,实际上是指氢离子的物质的量等于氢氧根离子的物质的量。
本题难度:一般
2、填空题 (7分)用稀盐酸和氢氧化钡溶液进行酸碱中和反应实验,该反应过程中溶液酸碱度变化及相关数据如右图所示。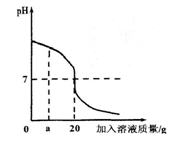
(1)根据此变化曲线,你认为实验操作是将?滴加到另一种溶液中。
(2)当加入溶液质量是a g时,溶液中溶质是?(写化学式)。
(3)若用pH试纸测定溶液的酸碱度,请写出测定方法:?。
(4)当pH=7时,测得生成氯化钡的物质的量为0.05mol,求盐酸中溶质的质量分数?
参考答案:(1)稀盐酸?(2)Ba(OH)2、BaCl2
(3)在玻璃片上放一小片pH试纸,用玻璃棒蘸取被测液,滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH(合理叙述均可)
(4)18.25%
本题解析:考查中和滴定、pH试纸的使用及溶液浓度的有关计算等。
(1)根据图像可知,在没有加入另一种溶液之前,溶液的pH大于7,这说明溶液显碱性,所以实验应该是将稀盐酸滴加到氢氧化钡溶液中。
(2)根据图像可知,当加入溶液质量是a g时,溶液的pH仍然是大于7的,即溶液还是显碱性的,氢氧化钡过量,所以溶液中的溶质是氢氧化钡和氯化钡。
(3)用pH试纸测定溶液的酸碱度的正确方法是在玻璃片上放一小片pH试纸,用玻璃棒蘸取被测液,滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH。
(4)pH=7时,说明二者恰好反应。因此根据氯原子守恒可知,氯化氢的物质的量是0.05mol×2=0.1mol,质量是3.65g。根据图像可知,恰好反应时,消耗盐酸是20g,所以盐酸的质量分数是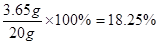 。
。
本题难度:一般
3、填空题 Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:
(1)该合成路线对于环境保护的价值在于 。
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因 。
(3)CH3OH、H2的燃烧热分别为:△H=-725.5 kJ/mol、△H=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
参考答案:(1)有利于防止温室效应 (2分)
(2)HOCH2CH2NH2+H2O HOCH2CH2NH3++OH- (2分)
HOCH2CH2NH3++OH- (2分)
(3)CO2(g)+3 H2(g)= CH3 OH(l)+ H2O(l) △H=-131.9kJ/mol (3分)
(4)< (1分),< (1分)
(5) CH3 OCH3 -12e-+16 OH-=2CO32-+11 H2O (3分 )
(6)9.6(2分 )
本题解析:(1)氢气与二氧化碳合成甲醇,减少了二氧化碳的排放,有利于防止温室效应
(2)HOCH2CH2NH2水解使溶液呈碱性,发生的离子方程式为HOCH2CH2NH2+H2O HOCH2CH2NH3++OH-
HOCH2CH2NH3++OH-
(3)根据盖斯定律,将甲醇与氢气的燃烧热化学方程式作相应调整,得△H=-285.8 kJ/mol×3-(-725.5 kJ/mol)=-131.9kJ/mol,所以合成甲醇的热化学方程式为CO2(g)+3 H2(g)= CH3 OH(l)+ H2O(l) △H=-131.9kJ/mol
(4)随温度升高,二氧化碳的转化率降低,说明升温平衡向逆向移动,正反应方向为放热反应,△H<0,反应物气体的总物质的量是8mol,生成物气体的总物质的量是4mol,所以△S<0;
(5)该电池负极是甲醚发生氧化反应,碱性介质中生成碳酸根离子,电极反应式为CH3 OCH3 -12e-+16 OH-=2CO32-+11 H2O
(6)0.5min甲醚的通入量是0.025mol,转移电子是0.3mol,根据得失电子守恒,Cu2++2e-=Cu,最终得0.15mol铜,其质量是9.6g。
考点:考查化学与工业的联系,生产对环境的影响,盖斯定律对应用,化学平衡理论的应用,电化学原理的应用
本题难度:困难
4、选择题 25℃时,浓度为0.1mol/L的某一元强碱MOH溶液与相同体积的某一元酸HA溶液混合后恰好呈中性。下列判断一定正确的是?(?)
A.HA酸溶液的pH值一定等于1
B.HA酸溶液的物质的量浓度一定等于0.1mol/L
C.中和后溶液中M+离子浓度一定等于A-离子浓度
D.中和后生成的盐MA一定没有发生水解
参考答案:C
本题解析:因酸碱都是一元的,所以恰好完全反应。由于酸HA的强弱不明确,要具体分析。若HA是强酸,则c=0.1mol/L,pH=1,此时A、B正确;若HA是弱酸,则c>0.1mol/L,MA水解。但,无论HA是强酸还是弱酸,溶液中的电荷恒等式c(H+)+c(M+)=c(OH-)+c(A-)总是成立的。
本题难度:一般
5、实验题 (14分)(Ⅰ)FeCl3的水溶液呈________(填“酸性”、“碱性”或“中性”),原因是__________________________________(用离子方程式表示);实验室配制FeCl3的水溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以___________(填“促进”、“抑制”)其水解;如果把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________________。
(Ⅱ)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:
(1)某次滴定时的滴定管中的液面如右图所示,其读数为 ?mL。
(2)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
参考答案:(Ⅰ)(1)酸性;Fe3++3H2O Fe(OH)3+3H+;抑制;Fe2O3?
Fe(OH)3+3H+;抑制;Fe2O3?
(Ⅱ)(1)22.60?(2)0.1250?(3)A、B、C、D
本题解析:(Ⅰ)把FeCl3溶液蒸干,水解平衡正向移动,生成Fe(OH)3,再灼烧,Fe2O3分解生成Fe2O3;
(Ⅱ)(1)读数时注意滴定管的刻度特点:小刻度在上,大刻度在下,且读到0.01 mL;
(2)首先要计算两次所用盐酸体积的平均值:
V1=25.40-0.50=24.9mL? V2="29.10-4.00=25.10" mL
则所用盐酸体积的平均值=(24.9+25.10)/2="25.00" mL
由NaOH+HCl=NaCl+H2O,得:C(NaOH)V(NaOH)= C(HCl)V(HCl),则
C(NaOH)=(0.10mol/L×25.00 mL)/20.00 mL="0.1250" mol/L;
(3)利用关系式C(NaOH)= C(HCl)V(HCl)/ V(NaOH)判断,
在代入数据时,C(HCl)=0.10mol/L,V(NaOH)="20.00" mL,所以,所有的不当操作都归结为对盐酸体积的读数;且C(NaOH)与V(HCl)成正比;
锥形瓶用待测液润洗后再注入待测液,n(NaOH)增多,导致V(HCl)增大,故使实验结果偏高;
酸式滴定管未用标准液润洗,将导致C(HCl)减小,消耗V(HCl)增大,故使实验结果偏高;
C中V(HCl)=V2-V1,滴定后仰视读数,导致V2增大,滴定前俯视读数,导致V1减小,则导致V(HCl)增大,故使实验结果偏高;
D将导致V(HCl)增大(多出的盐酸体积=气泡体积),故使实验结果偏高;
本题难度:一般