时间:2025-06-25 22:19:26
1、填空题 (10分)取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是_____________________________________________
_________________________________________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)________0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=________mol/L;c(OH-)-c(HA)=________mol/L。
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“>”、“<”或“=”)。
2、填空题 (5分)日常生活中,可用明矾[KAl(SO4)2·12H2O]作为净水剂,这是因为:明矾溶于水发生水解反应,生成氢氧化铝胶体。
(1)该反应的离子方程式为: ①?。
为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg[c(H+)/c(OH-)]。
(2)中性溶液的AG= ②??。
(3)常温下,测得用明矾净化过的净水溶液PH=6,则溶液的 AG=?③?,由水电离的c(H+)=④?。
3、选择题 室温下,某溶液中由水电离产生的c(H+)等于10-13 mol·L-1,该溶液的溶质不可能是( )
A.NaHSO4
B.NaCl
C.HCl
D.Ba(OH)2
4、选择题 能源可划分为一级能源和二级能源,自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取;未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列叙述正确的是:
A.水煤气,电能是一级能源
B.天然气,水力是二级能源
C.核能,煤,石油符合未来新能源标准
D.太阳能,生物质能,风能,氢能符合未来新能源标准
5、填空题 ( 12分)
(1)二甲醚燃料电池的正极反应式为?。电池在放电过程中,负极周围溶液的pH?。(填“增大”、“减小” 或“不变”)
(2)以上述电池为电源,通过导线电解池相连。两极为石墨,电解质溶液为1L
0.1mol/LKCl溶液,写出电解总反应的离子方程式为?。
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到右图(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。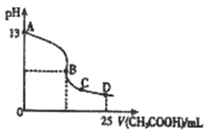
①若图中的B点pH=7,则滴定终点在?区间(填 “AB”、“BC”或“CD”)。
B点溶液中离子浓度大小为??。
②D点溶液中C(HAc)??C(Ac_ )(填> 、< 或= )。