时间:2025-06-25 22:19:26
1、选择题 常温时,下列三种溶液:
①0.001 mol·L-1氨水与0.001 mol·L-1 HCl溶液等体积混合液
②pH=3的HCl与pH=11的NaOH溶液等体积混合液
③pH=11的氨水与pH=3的HCl溶液等体积混合液。
其pH大小关系正确的是(?)
A.①=②=③
B.①>②=③
C.①<②=③
D.①<②<③
参考答案:D
本题解析:①中两者恰好反应生成氯化铵,溶液的pH<7;②中盐酸与氢氧化钠恰好完全反应,溶液的pH=7;③中氨水是弱碱,反应后过量,溶液的pH>7,故选项D符合。
本题难度:一般
2、选择题 有人建议有AG来表示溶液的酸度,AG的定义为AG=lg[c(H+)/c(OH-)]。则下列表述正确的是(?)
A.在25℃时,若溶液呈中性,则pH=7,AG=1
B.在25℃时,若溶液呈酸性,则pH〈7 AG〈0
C.在25℃时,若溶液呈碱性,则pH〉7 AG〉0
D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
参考答案:D
本题解析:在25℃时,若溶液呈中性,则pH=7,c(H+)=c(OH-),所以AG=0,A不正确;在25℃时,若溶液呈酸性,则pH〈7,c(H+)>c(OH-),所以AG>0,B不正确;在25℃时,若溶液呈碱性,则pH〉7,c(H+)<c(OH-),所以AG<0,C不正确,因此正确的答案选D。
点评:该题是中等难度的试题,试题基础性强,难易适中。注重对学生灵活运用基础知识解决实际问题的能力。该题的关键是明确溶液中水的离子积常数与氢离子浓度之间的换算关系,有利于培养学生的逻辑推理能力和自学能力,以及知识的迁移能力。
本题难度:简单
3、选择题 Ⅰ.已知在常温常压下:
① 2CH3OH(l)十3O2(g)=2CO2(g)+4H2O(g)?△H= -1275.6 kJ·mol—1
② H2O(l)=H2O(g)?△H="+" 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式?。
Ⅱ.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图: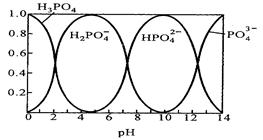
(1)在Na3PO4溶液中,c(Na+)/c(PO43-)??3(填“>”“=”“<”),向Na3PO4溶液中滴入稀盐酸后 ,pH从10降低到5的过程中发生的主要反应的离子方程式为??。
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是?。(填选项字母)
A、C(Na+)> C(H2PO4 -)>? C(H+)>? C(HPO4 2-)> C(H3PO4 )
B、C(Na+)> C(H2PO4 -)>? C(OH-)>? C( H3PO4)> C(HPO4 2- )
C、C(H+)+ C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4 )?
D、C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4 )?
(3)假设25℃条件下测得0.1 mol·L–1的Na3PO4溶液的pH=12 ,近似计算出Na3PO4的第一步水解的水解常数Kh(写出计算过程,忽略Na3PO4的第二、第三步水解,结果保留两位有效数字)。
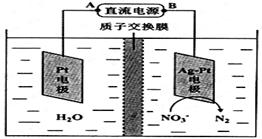
Ⅲ.化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染。电化学降解NO3-的原理如图所示。电源正极为?(填A或B),阴极反应式为?。
参考答案:Ⅰ.CH3OH(g)+3/2 O2(g)= CO2(g)+2H2O(l)?△H=-725.8kJ/mol?(2分)
Ⅱ.(1)>? HPO4 2- +? H+=?H2PO4 -?(每空2分,共4分)
(2)AD(2分)
(3)? PO43-?+? H2O 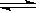 ?HPO4 2- +? OH-?(1分)
?HPO4 2- +? OH-?(1分)
起始浓度(mol·L–1): 0.1?0?0
变化浓度(mol·L–1): 0.01? 0.01? 0.01?
平衡浓度(mol·L–1): 0.09? 0.01? 0.01? (1分)
Kh?=C (HPO4 2-)× C(OH-)/? C( PO43- )=0.01 × 0.01 / 0.09 = 1.1 × 10 -3 mol·L–1
Ⅲ.?A? 2NO3-+10e-+12H+=6H2O +N2↑?(每空2分,共4分)
本题解析:Ⅰ.根据已知方程式和盖斯定律,甲醇燃烧的化学方程式为可由(①—②×4)÷2而得,因此表示甲醇燃烧热的热化学方程式为:CH3OH(g)+3/2 O2(g)= CO2(g)+2H2O(l)?△H=-725.8kJ/mol。
Ⅱ.(1)Na3PO4溶液中,PO43- 发生水解,因此c(Na+)/c(PO43-)>3,从磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线图可以看出,在pH从10降低到5的过程中,主要是HPO4 2- 的含量在逐渐减小为0,而H2PO4 – 的含量在逐渐增大,因此发生的主要反应的离子方程式为HPO4 2- +? H+=?H2PO4 - 。
(2)从图中可以看出,H2PO4 – 离子在酸性条件下才能大量存在,因此说明H2PO4 – 的电离大于水解,因此NaH2PO4溶液中有C(HPO4 2-)> C(H3PO4 ),又水电离出的一部分H+ ,因此离子浓度大小顺序有C(Na+)> C(H2PO4 -)>? C(H+)>? C(HPO4 2-)> C(H3PO4 ),因此A正确;由于H2PO4 – 发生水解和电离后,溶液中含P的微粒有H2PO4-、HPO42- 、PO43-、H3PO4?4种,因此电荷守恒式C错误;物料守恒式D正确。故选AD。
(3)根据溶液水解后的PH=12,可以计算水解产生的c(OH-)=0.01mol/L?,列成三段式有:
PO43-?+? H2O 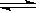 ?HPO4 2- +? OH-?
?HPO4 2- +? OH-?
起始浓度(mol·L–1): 0.1?0?0
变化浓度(mol·L–1): 0.01? 0.01? 0.01?
平衡浓度(mol·L–1): 0.09? 0.01? 0.01?
Kh?=C (HPO4 2-)× C(OH-)/? C( PO43- )=?0.01 × 0.01 / 0.09 = 1.1 × 10 -3 mol·L–1
Ⅲ.从原理示意图中可以看出,该装置是一个电解池装置,要降解的硝酸盐变成了N2,因此在图中的右侧发生了还原反应,该极为阴极,电源的A极则是正极。阴极反应的方程式为:2NO3-+10e-+12H+=6H2O +N2↑。
本题难度:困难
4、填空题 现有常温下的0.1 mol/l纯碱溶液。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是:________________。为证明存在上述平衡,进行如下实验:在0.1 mol·l-1纯碱溶液中滴加酚酞,溶液显红色,再往溶液中滴加?(填化学式)溶液,红色逐渐退为无色,说明上述观点成立。
(2)同学甲查阅资料得知0.1 mol/LNa2CO3中,发生水解的CO32—不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)。答:?。
(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中不正确的是?。
A.c(Na+)>2c(CO32—)
B.c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)
C.c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)
D.c(CO32—)+c(HCO3—)="0.1" mol·L-1
E.c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+c(CO32—)
(4)室温下pH均为a的Na2CO3和NaOH溶液中,水电离产生的c(OH—)之比=?。
参考答案:(1)CO32- + H2O HCO3- + OH-? BaCl2或CaCl2
HCO3- + OH-? BaCl2或CaCl2
(2)测0.1 mol·L-1Na2CO3溶液pH,pH≤12?(3)D、E?(4)10(2a-14)
本题解析:(1) 纯碱碳酸钠是强碱弱酸盐。在溶液中存在的水解平衡主要是CO32- + H2O HCO3- + OH-,还有HCO3- + H2O
HCO3- + OH-,还有HCO3- + H2O H2CO3-+ OH-。由于消耗了水电离产生的H+,所以最终使溶液中的c(OH-)>c(H+)。因此溶液显碱性。再往溶液中滴加与CO32-形成沉淀的物质如BaCl2或CaCl2,此时会放出沉淀反应,消耗了CO32-,c(CO32-)减小,尽管水解程度增大,但是单位体积中的OH-的物质的量减少,所以溶液的碱性减弱,红色逐渐退为无色。(2)在Na2CO3溶液中主要存在水解平衡CO32- + H2O
H2CO3-+ OH-。由于消耗了水电离产生的H+,所以最终使溶液中的c(OH-)>c(H+)。因此溶液显碱性。再往溶液中滴加与CO32-形成沉淀的物质如BaCl2或CaCl2,此时会放出沉淀反应,消耗了CO32-,c(CO32-)减小,尽管水解程度增大,但是单位体积中的OH-的物质的量减少,所以溶液的碱性减弱,红色逐渐退为无色。(2)在Na2CO3溶液中主要存在水解平衡CO32- + H2O HCO3- + OH-。c(CO32-)(始)=" 0.1" mol/L,若其水解程度等于10%,根据水解方程式可知:c(OH-)=0.01mol/L.c(H+)=10-12mol/L.pH=12.水解程度越大,水解产生的c(OH-)就越高,溶液的pH就越大。若水解程度小于10%,则c(H+)>10-12mol/L.pH<12.因此,测0.1 mol·L-1Na2CO3溶液pH,若pH≤12就证明0.1 mol/LNa2CO3中,发生水解的CO32—不超过其总量的10%。(3)A根据物料守恒可得c(Na+)=2c(CO32—)+2 c(HCO3—)+2c(H2CO3).所以c(Na+)>2c(CO32—) 。正确。B.在Na2CO3中存在水解平衡:CO32- + H2O
HCO3- + OH-。c(CO32-)(始)=" 0.1" mol/L,若其水解程度等于10%,根据水解方程式可知:c(OH-)=0.01mol/L.c(H+)=10-12mol/L.pH=12.水解程度越大,水解产生的c(OH-)就越高,溶液的pH就越大。若水解程度小于10%,则c(H+)>10-12mol/L.pH<12.因此,测0.1 mol·L-1Na2CO3溶液pH,若pH≤12就证明0.1 mol/LNa2CO3中,发生水解的CO32—不超过其总量的10%。(3)A根据物料守恒可得c(Na+)=2c(CO32—)+2 c(HCO3—)+2c(H2CO3).所以c(Na+)>2c(CO32—) 。正确。B.在Na2CO3中存在水解平衡:CO32- + H2O HCO3- + OH-, HCO3- + H2O
HCO3- + OH-, HCO3- + H2O H2CO3-+ OH-。主要是第一步水解,所以c(HCO3—)> c(H2CO3);但是盐水解的程度是很微弱的,盐的电离作用大于水解作用,所以c(CO32—)> >c(HCO3—)。由于两步水解都产生OH-,HCO3—第一步水解产生,而在第二步水解中由消耗。所以c(OH-)>c(HCO3—)。因此在溶液中离子间的关系为: c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)。正确。C.溶液显碱性。根据质子守恒可得:c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)。正确。D.根据物料守恒可得c(CO32—)+c(HCO3—)+ c(H2CO3)="0.1" mol/L.错误。E.根据电荷守恒可得c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+2c(CO32—).错误。(4)室温下pH均为a的Na2CO3溶液,c(H+)=10-a, c(OH-)(水)=10-14÷10-a =10a-14mol/L.对于pH=a的NaOH溶液c(H+)(水)= c(OH-)(水)=10-amol/L.所以水电离产生的c(OH—)之比=10a-14:10-a=10(2a-14)。
H2CO3-+ OH-。主要是第一步水解,所以c(HCO3—)> c(H2CO3);但是盐水解的程度是很微弱的,盐的电离作用大于水解作用,所以c(CO32—)> >c(HCO3—)。由于两步水解都产生OH-,HCO3—第一步水解产生,而在第二步水解中由消耗。所以c(OH-)>c(HCO3—)。因此在溶液中离子间的关系为: c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)。正确。C.溶液显碱性。根据质子守恒可得:c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)。正确。D.根据物料守恒可得c(CO32—)+c(HCO3—)+ c(H2CO3)="0.1" mol/L.错误。E.根据电荷守恒可得c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+2c(CO32—).错误。(4)室温下pH均为a的Na2CO3溶液,c(H+)=10-a, c(OH-)(水)=10-14÷10-a =10a-14mol/L.对于pH=a的NaOH溶液c(H+)(水)= c(OH-)(水)=10-amol/L.所以水电离产生的c(OH—)之比=10a-14:10-a=10(2a-14)。
本题难度:一般
5、选择题 下列能源中,属于可再生绿色能源的是
A.天然气
B.氢气
C.液化气
D.煤气
参考答案:B
本题解析:氢气的燃烧产物是水,对环境不会造成污染,且是可再生的,其余选项都是化石燃料或以化石燃料为原料生成的,不属于可再生绿色能源,答案选B。
点评:该题是常识性知识的考查,难度不大。主要是考查学生对绿色能源的了解掌握情况,旨在培养学生的环境保护意识和能源节约意识。
本题难度:简单