时间:2025-06-25 21:59:49
1、填空题 已知下列三个热化学方程式
①H2(g)+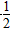 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol-1
写出表示碳燃烧生成CO和CO燃烧生成CO2的燃烧热的热化学方程式。 _________________________________________; _________________________________________。
参考答案:C(s)+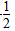 O2(g)===CO(g) ΔH=-110.8 kJ·mol-1
O2(g)===CO(g) ΔH=-110.8 kJ·mol-1
CO (g)+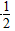 O2(g)===CO2(g) ΔH=-282.7 kJ·mol-1
O2(g)===CO2(g) ΔH=-282.7 kJ·mol-1
本题解析:
本题难度:一般
2、选择题 如下图所示,△H1=-393.5 kJ/mol,△H2=-395.4 kJ/mol,下列说法或表示式正确的是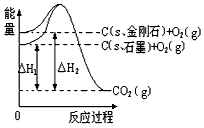
[? ]
A.C(s、石墨)== C(s、金刚石) △H= +1.9 kJ/mol
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
参考答案:A
本题解析:
本题难度:一般
3、填空题 “神七”登天标志着我国的航天事业进入了新的篇章.
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温.为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是______.
A.在高温下不融化?B.在常温下就分解气化?C.在高温下可汽化或者分解D.该涂料不可能发生分解
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.已知:
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
NO2(g)?
| 1 2 |
参考答案:(1)涂料起散热作用,因为物质汽化或者分解时从周围吸收热量,从而起到降温作用,故该物质在高温下应该具有汽化或者分解的性质;
故选C;
(2)已知:①、N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1
②、N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
③、NO2(g)?12N2O4(g)△H=-26.35kJ?mol-1
根据盖斯定律,②×2-①-③×2得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) 故△H=2×(-534.0kJ?mol-1)-67.7kJ?mol-1-2×(-26.35kJ?mol-1)=-1073.2kJ?mol-1,
故热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1073.2kJ?mol-1;
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1073.2kJ?mol-1;
(3)原电池正极反应还原反应,氧气在正极放电,正极电极反应式为:O2+2H2O+4e-=4OH-,电池总反应为:N2H4+O2=N2+2H2O,电池总反应式减去正极反应式可得负极电极反应式:N2H4+4OH--4e-=N2+4H2O;
故答案为:O2+2H2O+4e-=4OH-;N2H4+4OH--4e-=N2+4H2O;
本题解析:
本题难度:一般
4、选择题 已知25℃、101kPa条件下:①4Al(s)+3O2(g)==2Al2O3(s);△H=-2834.9 kJ/mol;
②4Al(s)+2O3(g)==2Al2O3(s);△H=-3119.1 kJ/mol。由此得出的正确结论是
[? ]
A.等质量的O2比O3的能量低,由O2变O3为放热反应
B.等质量的O2比O3的能量高,由O2变O3为吸热反应
C.O2比O3稳定,3O2(g)== 2O3(g) △H=-284.2 kJ/mol
D.O2比O3稳定,3O2(g)== 2O3(g) △H=+284.2 kJ/mol
参考答案:D
本题解析:
本题难度:一般
5、选择题 25℃、101kPa下:
①2Na(s)+1/2O2(g)=Na2O(s) △H= -414kJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H= -511kJ/mol
下列说法正确的是
[? ]
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25℃、101kPa下:Na2O2(s)+2Na(s)=2Na2O(s) △H= -317kJ/mol
参考答案:D
本题解析:
本题难度:一般