时间:2025-06-25 21:59:49
1、简答题 2010年上海世博会的三大主题是“低碳、和谐、可持续发展”,意在倡导人们合理、科学地利用能源,提高能源的利用率.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了全社会的普遍关注.
(1)科学家们提出利用工业废气中的CO2可制取甲醇.已知在常温常压下,反应的热化学方程式:①CO(g)+2H2(g)═CH3OH(g)△H1=-90kJ?mol-1;②CO(g)+H2O(g)═CO2(g)+H2(g)△H2=-41kJ?mol-1,写出由二氧化碳、氢气制备甲醇的热化学方程式:______.
(2)在体积为1L的密闭容器中,充入1molCO2和2.5molH2在图1示条件下测得CO2和CH3OH(g)的物质的量随时间变化如图所示.
①从反应开始到平衡,平均反应速率v(H2)=______;
②反应的平衡常数K=______;
③下列对二氧化碳、氢气制备甲醇的有关叙述正确的是______(填字母).
A.升高温度正反应速率减慢,逆反应速率加快
B.当3v正(H2)=v逆(CO2)时,该反应达到了平衡状态
C.将H2O(g)从体系中分离出来,可提高CO2和H2的转化率
D.再充入1molCO2和3molH2,可使n(CH3OH)/n(CO2)增大
(3)某实验小组依据甲醇燃烧的反应原理,设计如图2所示的燃料电池装置.
①该电池工作时,OH-向______极移动(填“正”或“负”),该电池正极的电极反应式为:______.
②以该燃料电池作为电源,电解精炼铜.若粗铜中含锌、银、金等杂质,则通电一段时间后,阳极减少的质量将(填“大于”、“等于”或“小于”)______阴极增加的质量.当阴极质量增加64g时,该燃料电池理论上需消耗O2的体积为______L(标准状况下).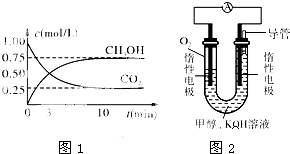
2、选择题 氯原子对O3分解有催化作用:Cl+O3=ClO+O2 △H1;ClO+O=Cl+O2 △H2大气臭氧层的分解反应是:O+O3=2O2 △H,该反应的能量变化示意图如图所示:下列叙述中,正确的是( )
A.反应O+O3=2O2的△H=E1-E3
B.O+O3=2O2是放热反应
C.△H=△H1+△H2
D.大气层中的臭氧无法再生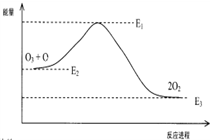
3、填空题 已知:(1)P4(s,白磷)+ 5O2(g) == P4O10(s) △H1=-2983.2 kJ/mol
(2)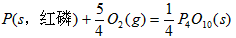 ?
?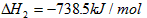
则白磷转化为红磷的热化学方程式_____________________ 。 相同的状况下,能量较低的是________;白磷的稳定性比红磷___________(填“高”或“低”)。
4、填空题 已知:2Al (s)+3/2O2(g)=== Al2O3(s) △H= -1 644.3 kJ·mol-1
2Fe (s) +3/2O2(g)=== Fe2O3(s) △H= -815.88 kJ·mol-1 试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式______________________。
5、简答题 二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10.0MPa,温度230~280℃)进行的反应为:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1,
(1)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=______.
(2)在温度和容积不变的条件下发生反应①,能说明该反应达到化学平衡状态的依据是______(多选扣分).
a.容器中压强保持不变;b.混合气体中c(CO)不变;c.v正(CO)=v逆(H2);d.c(CH3OH)=c(CO)
(3)在2L的容器中加入amo1CH3OH(g)发生反应②,达到平衡后若再加入amo1CH3OH(g)重新达到平衡时,CH3OH的转化率______(填“增大”、“减小”或“不变”).
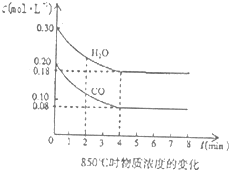
(4)850℃时在一体积为10L的容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示.
①0~4min的平均反应速率υ(CO)=______.
②若温度不变,向该容器中加入4mo1CO、2mo1H2O、3mo1CO2(g)和3mo1H2(g),起始时D正______V逆(填“<”、“>”或“=”),请结合必要的计算说明理由______.