时间:2025-06-25 21:47:33
1、填空题 已知:2SO3 2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
(1)反应达平衡所需时间A?B(大于;等于;小于);达平衡时SO3的转化率
A?B(大于;等于;小于)。
(2)若平衡后,向A、B中分别充入惰性气体,?容器的平衡将向?方向移动;若平衡后,向A、B中分别充入等物质的量SO3,重新达平衡时,两容器中的SO3转化率变化情况是(填变大、变小、不变)A?,B?
参考答案:
(1)小于;小于(各1分,共2分)
(2)B;正反应;变小;不变(各1分,共4分)
本题解析:
本题考查化学平衡移动;2SO3 2SO2+O2,是一气体总物质的量增大的反应。(1)相同温度下,充入SO3,A容器保持体积不变,压强变大;B容器保持压强不变,体积增大,达到平衡状态时转化为状态C(如下图),故达到平衡所用时间,A小于B;假设B中的活塞不移动,由于A、B两个容器的体积、温度相同,达到平衡时A、B两容器中存在的平衡是等效平衡,其中SO3的转化率也相等。对于B和C两个状态,B中压强小于C中压强,因此C中SO3转化率大于B中SO3转化率。由此可以判断出C中SO3的转化率也大于A中SO3的转化率, 故达到平衡时,SO3的转化率 A小于B。
2SO2+O2,是一气体总物质的量增大的反应。(1)相同温度下,充入SO3,A容器保持体积不变,压强变大;B容器保持压强不变,体积增大,达到平衡状态时转化为状态C(如下图),故达到平衡所用时间,A小于B;假设B中的活塞不移动,由于A、B两个容器的体积、温度相同,达到平衡时A、B两容器中存在的平衡是等效平衡,其中SO3的转化率也相等。对于B和C两个状态,B中压强小于C中压强,因此C中SO3转化率大于B中SO3转化率。由此可以判断出C中SO3的转化率也大于A中SO3的转化率, 故达到平衡时,SO3的转化率 A小于B。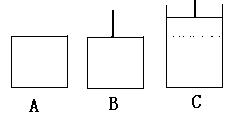
(2)达到平衡后,分别充入惰性气体,A容器体积不变,反应体系的浓度不变,平衡不移动,B容器保持压强不变,体积增大,平衡向右移动;如果充入SO3,A容器保持体积不变,压强变大,SO3的转化率减小,B中充入SO3,与原平衡为等效平衡,SO3的转化率不变。
本题难度:一般
2、选择题 已知溶液中存在Cr2O72-+ H2O 2CrO42-+ 2H+的平衡,其中Cr2O72-呈橙色,CrO42-呈黄色,向该平衡体系中滴加饱和NaOH溶液时,颜色的变化情况是
2CrO42-+ 2H+的平衡,其中Cr2O72-呈橙色,CrO42-呈黄色,向该平衡体系中滴加饱和NaOH溶液时,颜色的变化情况是
A.黄色加深
B.橙色加深
C.颜色不变
D.颜色褪去
参考答案:A
本题解析:
Cr2O72-+ H2O 2CrO42-+ 2H+,向该平衡体系中滴加饱和NaOH溶液时,H+浓度减小,平衡正向移动,黄色加深,A正确。
2CrO42-+ 2H+,向该平衡体系中滴加饱和NaOH溶液时,H+浓度减小,平衡正向移动,黄色加深,A正确。
本题难度:简单
3、选择题 对可逆反应N2 + 3H2 2NH3,下列描述能说明反应已达平衡的是?(?)?
2NH3,下列描述能说明反应已达平衡的是?(?)?
A.单位时间内有a mol N2消耗,同时生成2a mol NH3
B.氨气的浓度不再变化
C.容器内氮气、氢气、氨气的浓度之比为1︰3︰2
D.化学反应速率关系是:2v正(NH3) = 3v逆(H2)
参考答案:B
本题解析:略
本题难度:简单
4、填空题 已知2A2(g) + B2(g) 2C(g)
2C(g)  H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
(1)a?b(填“>”“=”或“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将?(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达到平衡后,吸收热量c kJ,C的浓度?w mol/L(填“>”“=”或“<”),a,b,c之间满足何种关系:?(用等式表示)。
(4)能说明该反应已经达到平衡的状态的是?。
a.ν(C)=2ν(B2)?b.容器内压强保持不变
c.ν(逆)(A2)=ν(正)(B2)? d.容器内的密度保持不变
参考答案:(1)> ?(2)减小?(3)=? a=b+c?(4)b
本题解析:(1)2A2(g) + B2(g) 2C(g)
2C(g)  H=" -a" kJ/mol(a>0),表示2molA和1molB完全反应生成2molC释放akJ的能量,在500℃是充分反应达到平衡时生成的C小于2molC,那放出热量b kJ,一定小于akJ;
H=" -a" kJ/mol(a>0),表示2molA和1molB完全反应生成2molC释放akJ的能量,在500℃是充分反应达到平衡时生成的C小于2molC,那放出热量b kJ,一定小于akJ;
(2)因为反应的 H<0,温度越高,K越小。
H<0,温度越高,K越小。
(3)在同一容器同一条件下 2molA2和1molB2建立的平衡和2mol C建立的平衡时等效平衡。所以平衡后C的浓度仍为w mol/L,且a=b+c;(4)该容器恒容,反应中全部是气体,所以密度始终不变,d不行;该反应的 Vg≠0,容器内压强保持不变时,说明反应已达平衡状态,b可以;a不能体现ν(逆) =ν(正),C.用AB速率表示平衡状态应该是ν(逆)(A2)=2ν(正)(B2) ,c错误。
Vg≠0,容器内压强保持不变时,说明反应已达平衡状态,b可以;a不能体现ν(逆) =ν(正),C.用AB速率表示平衡状态应该是ν(逆)(A2)=2ν(正)(B2) ,c错误。
本题难度:一般
5、选择题 某密闭容器中存在2NO+O2 2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是
2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是
A.该反应的正反应是吸热反应
B.若温度为T1、T3时的平衡常数分别为K1、K3,则K1<K3
C.T1时,当反应处于D点,则该反应的逆反应速率大于正反应速率
D.如果缩小容器体积,则平衡时表示NO转化率与温度变化关系的曲线在原曲线上方
参考答案:D
本题解析:A、根据图像可知,随着温度的升高,NO的转化率逐渐降低。这说明升高温度平衡向逆反应方向进行,因此正反应是放热反应,A不正确;B、升高温度平衡向逆反应方向进行,平衡常数降低,因此若温度为T1、T3时的平衡常数分别为K1、K3,则K1>K3,B不正确;C、T1时,当反应处于D点时,要想达到平衡状态,则在温度不变的情况下,NO的转化率增大,这说明反应向正反应方向进行,则该反应的逆反应速率小于正反应速率,C不正确;D、如果缩小容器体积,压强增大,平衡向正反应方向进行,NO的转化率增大,则平衡时表示NO转化率与温度变化关系的曲线在原曲线上方,D正确,答案选D。
本题难度:简单