时间:2025-06-25 21:47:33
1、填空题 以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8× 10-19 10-19 |
| AlAsO4 | 1.6×1 0-16 0-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g/L | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
2、选择题 下列改变一定能说明化学平衡发生移动的是(?)
A.反应混合物中各物质的浓度的改变
B.反应物转化率的改变
C.正逆反应速率的改变
D.反应容器中压强的改变
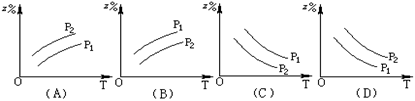
3、选择题 如图所示,反应:X(气)+3Y(气)? 2Z(气)+Q(Q>0),在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为?(?)
4、选择题 可逆反应达到最大反应限度的本质特征是( )。
A.反应停止了
B.正逆反应的速率均为零
C.正逆反应都还在继续进行
D.正逆反应的速率相等
5、填空题 (16分)可逆反应2 Cl2 (g)+2H2O(g)  4HCl(g)+O2 (g)?ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)
4HCl(g)+O2 (g)?ΔH>0,在一定条件下达到平衡后,分别采取下列措施,试回答:(1-4题填“增大”、“减小”、或“不变”)
(1)降低温度,Cl2的转化率__?_____,平衡常数K?
(2)保持容器体积不变,加入He,则HCl的物质的量______________
(3) 保持容器体积不变,加入Cl2,则Cl2的转化率_________,平衡常数K?
(4)若恒温恒容,反应从Cl2和H2O开始至平衡,在这个变化过程中,平均相对分子质量____。
(5)反应体系中加入催化剂对反应热是否有影响?______________________,原因是_______;