时间:2025-06-25 21:19:44
1、填空题 (1)上表中的实线是元素周期表部分边界,请在表中用实线画出金属元素的边界(实线内的元素全是金属元素)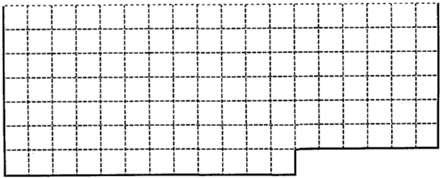
(2)元素甲是第三周期ⅦA族元素,化合物A是由甲元素等非金属元素组成的离子化合物写出其化学式______,
(3)元素乙是第三周期原子半径最小的金属元素,丙是短周期元素中原子半径最大的元素,用电子式表示丙在空气中加热反应生成B的形成过程______.B中含有的化学键是______
(4)化合物C是由甲元素和乙元素形成的化合物,将化合物A与化合物C等物质的量溶于水中,向其中滴加过量的2mol?L-1氢氧化钠溶液,直至形成透明溶液.请根据实验现象出现的先后顺序,依次写出离子方程式:__________________.
(5)实验中丙元素的鉴别方法______(不写过程)与现象______.
参考答案:(1)元素周期表的结构以及元素的分布情况,表示元素周期表的部分边界如下: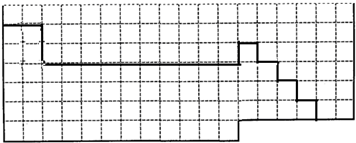
,故答案为:
;
(2)第三周期ⅦA族元素是Cl,由Cl元素等非金属元素组成的离子化合物是氯化铵,故答案为:NH4Cl;
(3)第三周期原子半径最小的金属元素为Al,短周期元素中原子半径最大的元素是Na,钠在空气中加热反应生成过氧化钠,它的形成过程可以表示为: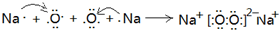
,在过氧化钠中,钠离子和过氧根之间是离子键,过氧根中氧和氧之间是共价键,故答案为: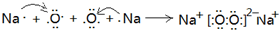
;离子键和非极性键(或离子键和共价键);
(4)化合物C是氯化铝,将化合物氯化铵与化合物氯化铝等物质的量溶于水中,向其中滴加过量的2mol?L-1氢氧化钠溶液,直至形成透明溶液铝离子先和氢氧化钠反应生成氢氧化铝沉淀,然后是铵根离子和氢氧根之间的反应,最后是氢氧化铝溶解的过程,故答案为:Al3++3OH-=Al(OH)3;NH4++OH-=NH3+H2O(NH3?H2O);Al(OH)3+OH-=AlO2-+H2O;
(5)含有钠元素的化合物的检验可以采用颜色反应的方法,颜色反应为黄色,故答案为:焰色反应;火焰呈现黄色.
本题解析:
本题难度:一般
2、选择题 下列叙述中错误的是
A.原子半径Na>Si>Cl
B.金属性Na>Mg>Al
C.稳定性SiH4<HCl<H2S
D.酸性H3PO4<H2SO4<HClO4
参考答案:C
本题解析:四个选项中所列元素为Na、Mg、Al、Si、P、S、Cl,同为三个电子层,最外层电子数依次为1到7,其原子半径、金属性、气态氢化物的稳定性、最高价氧化物的水化物的酸碱性均呈现出规律性的变化.不难得出:气态氢化物的稳定性应为SiH4<H2S<HCl.A、B、D是正确的比较.
本题难度:一般
3、推断题 已知A、B、C、D、E都是周期表中短周期的主族元素,它们的原子序数依次增大。A原子的最外层电子数是次外层的2倍,B、D的氧化物是导致酸雨的主要物质,C元素在短周期元素中第一电离能最小(下列涉及A、B、C、D、E请用元素符号填充)。
(1)D、E元素电负性大小关系为__________。
(2)B、D的氢化物的分子空间构型分别为__________、__________。
(3)根据等电子理论可知,A的某种氧化物(AO)的结构式为__________。
(4)相对分子质量为28的A的氢化物分子中,A原子杂化类型为__________,分子中σ键与π键数目之比为__________。
(5)C与E形成的晶体,其结构如图所示。晶体中离子的配位数(即与一种离子周围紧邻的带相反电荷的离子数目)为__________,一个晶胞中C离子数目为__________个。 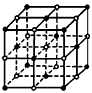
参考答案:(1)Cl>S
(2)三角锥型;V型
(3)C≡O
(4)sp2;5:1
(5)6;4
本题解析:
本题难度:一般
4、选择题 若原子核外电子排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第二层电子数不超过15个,而且各电子层容纳电子数最多为2n2个,则元素周期表中第3、4、5周期含有的元素分别有
[? ]
A.5种、10种、15种
B.8种、18种、18种
C.8种、10种、15种
D.9种、10种、15种
参考答案:C
本题解析:
本题难度:一般
5、选择题 根据元素的单质和化合物性质判断元素非金属性强弱的依据一般是( )
A.元素最高价氧化物的水化物的碱性强弱
B.元素氧化物的水化物的酸性强弱
C.元素单质跟酸反应置换出氢的难易
D.元素的单质跟氢气生成气态氢化物的难易
参考答案:A.比较元素的非金属性强弱,可根据最高价氧化物对应水化物的酸性强弱,故A错误;
B.应是最高价氧化物的水化物的酸性强弱,当化合价不是最高价时,不能用于比较,故B错误;
C.非金属性元素不能与酸发生置换反应生成氢气,角度错误,故C错误;
D.元素的非金属性越强,元素对应的单质越易与氢气发生化合反应,故D正确.
故选D.
本题解析:
本题难度:一般