时间:2025-06-25 21:18:08
1、填空题 铜是生命必需的元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面产生了深远的影响。在化学反应中,铜元素可表现的价态为0、+1、+2。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜〔即曾青(CuSO4)跟铁反应生成铜〕。试写出该反应的离子方程式___________________________________________。
(2)尽管铜比铁较为稳定,但铜器表面经常会生成铜锈〔即铜绿,化学式:Cu2(OH)2CO3〕,其中生成铜绿的反应物除铜外还有O2、CO2和H2O。试写出保护铜制品的方法:_________________________。
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1183.4℃,铁的熔点是1534.8℃)
?。
参考答案:(1)Fe+Cu2+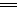 Fe2++Cu
Fe2++Cu
(2)干燥空气中保存
(3)铜的化学性质比较稳定,不易被腐蚀,铜的熔点比较低,容易冶炼铸造成型
本题解析:根据题目信息可知硫酸铜与铁反应的离子方程式为Fe+Cu2+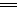 Fe2++Cu;由于铜在潮湿的空气中容易与CO2作用产生碱式碳酸铜,所以铜应保存在干燥的空气中。
Fe2++Cu;由于铜在潮湿的空气中容易与CO2作用产生碱式碳酸铜,所以铜应保存在干燥的空气中。
本题难度:简单
2、计算题 在某些硫酸铜溶液中,加入一个质量为1.12g的铁片,经过一段时间,铁片表面覆盖了一层红色的铜,取出洗净、烘干,称重,质量变为1.16g.计算在这个化学反应中溶解了铁多少克?析出了铜多 少克?
少克?
参考答案:溶解了铁0.28g析出了铜0.32g
本题解析:Fe+C uSO4=FeSO4+Cu,从化学方程可以看出,铁片质量的增加,与铁的溶解和铜的析出直接联系,每溶解56g铁,将析出64g铜,会使铁片,质量增加: 64g-56g=8g
uSO4=FeSO4+Cu,从化学方程可以看出,铁片质量的增加,与铁的溶解和铜的析出直接联系,每溶解56g铁,将析出64g铜,会使铁片,质量增加: 64g-56g=8g
根据铁片增加的质量(1.16g-1.12g),可计算出溶解的Fe的质量和析出的Cu的质量.
解:设溶解的Fe为xg,析出的Cu为yg
Fe=CuSO4=Cu+FeSO4?质量差
56 64 ? 64-56
x y ? 1.16-1.12
则: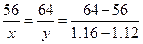 ,解
,解 得:x="0.28(g)?" y=0.32(g)
得:x="0.28(g)?" y=0.32(g)
本题难度:简单
3、选择题 下列有关铁及其化合物的说法中正确的是
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D.常温下,将铁钉投入浓硝酸中可生成Fe(NO3)2
参考答案:C
本题解析:A项赤铁矿的主要成分应是Fe2O3而不是Fe3O4;B项铁与水蒸气在高温下的反应产物为Fe3O4和H2,不是Fe2O3;C项正确;D项浓硝酸氧化性强,产物应为三价铁。
点评:熟记铁及其化合物的相关性质,此题属于简单题型
本题难度:一般
4、填空题 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: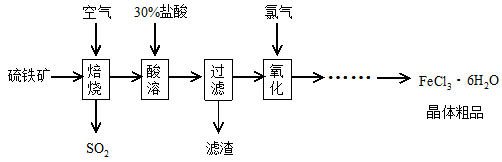
回答下列问题:
(1)焙烧硫铁矿的主要方程式为?。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、??。
(3)通氯气氧化后时,发生的主要反应的离子方程式为??;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式)?。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:?。
(5)如果将氯化铁晶体(FeCl3·6H2O)放在坩埚中加热灼烧,最后得到的固体为?。
(6)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K=??; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率?。
2SO3(g),该反应的平衡常数表达式为K=??; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率?。
①V2O5作崔化剂?②通入过量O2?③SO2、O2进行二次氧化?④通入过量SO2
参考答案:(1)4 FeS2 + 11 O2 2 Fe2O3 +? 8SO2(2分)
2 Fe2O3 +? 8SO2(2分)
(2)抑制Fe3+水解(2分)
(3)Cl2+Fe2+=2Cl-+Fe3+ (2分) Cl2?HCl(2分)
(4)取氧化后的溶液少许于试管中,往试管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫红色不褪去,说明铁元素全部以Fe3+形式存在。(2分)
(5)Fe2O3(2分)
(6)k=c2(SO3)/c(O2)·c2(SO2) (2分)?②③(2分)
本题解析:(1)焙烧硫铁矿是硫酸工业中制取二氧化硫气体的重要步骤,发生的氧化还原反应配平比较困难,利用电子得失守恒配平得: 4 FeS2 + 11 O2 2 Fe2O3 +? 8SO2(2分)
2 Fe2O3 +? 8SO2(2分)
(2)酸溶焙烧产物不仅是提高浸出率,还可以抑制溶解得到的Fe3+水解。
(3)因为最终要得到的产品是氯化铁晶体,所以可能焙烧不完全,仍有部分亚铁离子,所以加入氧化剂氯气氧化除去,发生的反应为Cl2+Fe2+=2Cl-+Fe3+ ,该过程可能有氯气溶于水产生挥发性的HCl以及过量的Cl2,所以可以用碱吸收。
(4)检验是否全部转化为Fe3+ ,就是检验Fe2+ 的存在,所以检验Fe2+ 可以使用高锰酸钾试剂,所以操作为:取氧化后的溶液少许于试管中,往试管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫红色不褪去,说明铁元素全部以Fe3+形式存在。
(5)氯化铁晶体(FeCl3·6H2O)含有水分,所以加热灼烧过程中,FeCl3 会发生水解并最终得到稳定的氧化物Fe2O3 。
(6)根据方程式可以写出平衡常数表达式为k=c2(SO3)/c(O2)·c2(SO2);要提高SO2 的转化率,则需要使平衡正向移动或SO2 二次利用,所以可行的是②、③。
本题难度:困难
5、选择题 使a g Fe粉与一定量的硝酸溶液充分反应(Fe粉完全溶解),生成的气体与标准状况下b L O2混合后,恰好能被水完全吸收,a和b的关系可能是
A.b >0.3a
B.b <0.2a
C.0.2a<b <0.3a
D.无法确定
参考答案:C
本题解析:根据题意可知,生成的气体和氧气恰好反应时生成的是硝酸,即铁所失去的电子最终又被氧气得到,所以根据电子的得失守恒可知,如果铁的氧化产物是铁离子,则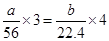 ;如果是亚铁离子,则
;如果是亚铁离子,则 ,所以答案选C。
,所以答案选C。
本题难度:一般