时间:2025-06-25 21:18:08
1、选择题 已知在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为4:2:1,现加入适量的铁粉,使溶液中的三种离子的物质的量浓度之比为1:3:9,则投入的铁粉与原溶液中Cu2+的物质的量之比为
A.3:5
B.5:6
C.5:4
D.2:3
参考答案:B
本题解析:因为铁粉先与Fe3+反应,再与Cu2+反应,反应后的溶液中还有Fe3+,说明铁粉没有与Cu2+反应,只发生一个反应Fe+2FeCl3=3FeCl2,设铜离子为x mol,则反应前的Fe3+、Fe2+为2x mol、x/2mol,反应后的Fe3+、Fe2+为x/3 mol、3x mol,则加入的铁粉为5x/6 mol,故选B。
点评:本题中要考虑Fe3+、Cu2+、Fe2+氧化性强弱顺序。属于中等题。
本题难度:一般
2、选择题 现有19.7 g由Fe、FeO、Al、Al2O3组成的混合物,将它完全溶解在540 mL 2.00 mol·L-1的H2SO4溶液中,收集到标准状况下的气体8.96 L。已知混合物中,Fe、FeO、Al、Al2O3的质量分数分别为0.284、0.183、0.274和0.259。欲使溶液中的金属阳离子完全转化为氢氧化物沉淀,至少应加入2.70 mol·L-1的NaOH溶液体积是
A.600
B.300
C.800
D.900
参考答案:C
本题解析:略
本题难度:一般
3、计算题 (13分)将8.6 g的铜银合金完全溶于浓HNO3,若反应中硝酸的还原产物只有NO2和N2O4,且它们的体积均为1.12 L(标准状况),则该铜银合金中铜和银的质量分别为多少?
参考答案:3.2 g? 5.4 g
本题解析: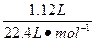 ="0.05" mol
="0.05" mol
设合金中Cu为x mol,Ag为y mol。则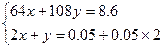 解得
解得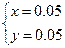
所以m(Cu)="64" g·mol-1×0.05 mol="3.2" g
m(Ag)="8.6" g-3.2 g="5.4" g
本题难度:简单
4、选择题 FeSO4和Fe2(SO4)3的混合物中含硫的质量分数为a%,则含铁的质量分数为(? ).
A.2a%
B.3a%
C.1-2a%
D.1-3a%
参考答案:D
本题解析:在FeSO4和Fe2(SO4)3的混合物中,硫元素和氧元素质量比是固定的,即1:2,所以,氧的质量分数为2%,铁的质量分数为1-3a%,故选D
本题难度:一般
5、选择题 某同学进行下列实验:在加热条件下将24gCuO、Fe2O3的混合物与充足的CO完全反应,并将反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40g。下列有关叙述中不正确的是(?)
A.原混合物中CuO与Fe2O3物质的量比为1:1
B.反应后所得C O2的物质的量为0.4mol
O2的物质的量为0.4mol
C.实验过程中需要的CO 质量为11.2g
D.原混合物中CuO与Fe2O3的质量比为1:2
参考答案:C
本题解析:略
本题难度:一般