时间:2025-06-25 21:18:08
1、实验题 [2012·潍坊一模] (14分)黄铜矿的主要成分是CuFeS2,是工业炼铜的主要原料。已知黄铜矿在空气中焙烧生成Cu、FeS和SO2,FeS+2HCl=FeCl2+H2S↑,H2S是一种剧毒气体。某科研小组设计以黄铜矿为原料制取单质铜和氯化铁晶体(FeCl3·6H2O)的流程如下:
?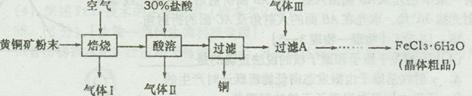
(1)92gCuFeS2在空气中焙烧生成Cu、FeS和SO2转移电子的物质的量为?。
(2)请简述检验气体Ⅰ的操作步骤?。
(3)在实验室中,欲用38%(密度为1.18g·mL-1)的盐酸配制30%的盐酸,需要的玻璃仪器主要有?。
(4)气体Ⅲ最好选用?(填写序号),其主要作用是?。
A.O2
B.H2
C.Cl2
D.N2
欲选用下列仪器在实验室中制取纯净干燥的该气体。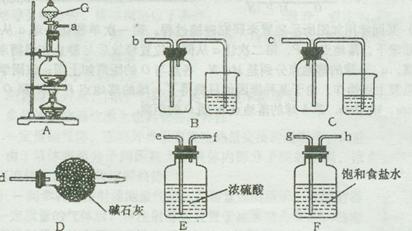
装置A中发生反应的离子方程式为?。
选用合适装置导管口的连接顺序为a接?。图中仪器G的名称是?;在使用该仪器时,应首先?。
参考答案:(14分)(1)3mol
(2)收集适量气体Ⅰ通入品红溶液中,溶液褪色,加热溶液恢复红色
(3)玻璃棒、烧杯、量筒
(4)C?把Fe2+氧化成Fe3+?MnO2+4H++2Cl- MnCl2+Cl2↑+2H2O? ghefb?分液漏斗?检验其是否漏水
MnCl2+Cl2↑+2H2O? ghefb?分液漏斗?检验其是否漏水
本题解析:(1)n(CuFeS2)=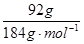 =0.5mol, CuFeS2(Cu、Fe、S的化合价分别为+2、+2和–2价)在空气中焙烧生成Cu、FeS和SO2的化学方程式为CuFeS2+O2
=0.5mol, CuFeS2(Cu、Fe、S的化合价分别为+2、+2和–2价)在空气中焙烧生成Cu、FeS和SO2的化学方程式为CuFeS2+O2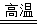 Cu+FeS+SO2↑,分析化学方程式知,1mol CuFeS2参加反应转移6mol电子,故0.5mol CuFeS2参加反应转移3mol电子。
Cu+FeS+SO2↑,分析化学方程式知,1mol CuFeS2参加反应转移6mol电子,故0.5mol CuFeS2参加反应转移3mol电子。
(2)根据题给信息,黄铜矿焙烧生成的气体Ⅰ是SO2,检验SO2的方法是将气体通入品红溶液中,溶液褪色,加热溶液恢复红色。
(3)用溶液配制一定质量分数的溶液,要用到的玻璃仪器有量筒、烧杯和玻璃棒。
(4)气体Ⅲ的作用是将FeCl2氧化成FeCl3,故最好选用Cl2;实验室中用MnO2和浓盐酸在加热条件下制取Cl2,反应的离子方程式为MnO2+4H++2Cl- MnCl2+Cl2↑+2H2O。从导气管口a处流出的气体除Cl2外,还含有杂质气体HCl和水蒸气,应首先用装置F除HCl气体,然后用装置E除水蒸气,最后选择装置B用向上排空气法收集Cl2,故导气管口的连接顺序为ghefb。仪器G是分液漏斗,使用该仪器时要检验是否漏水。
MnCl2+Cl2↑+2H2O。从导气管口a处流出的气体除Cl2外,还含有杂质气体HCl和水蒸气,应首先用装置F除HCl气体,然后用装置E除水蒸气,最后选择装置B用向上排空气法收集Cl2,故导气管口的连接顺序为ghefb。仪器G是分液漏斗,使用该仪器时要检验是否漏水。
本题难度:一般
2、计算题 钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末。
②取m g该粉末,放人28.00 mL 1 mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
③再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00 mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入粉末质量/g | 13.68 | 27.36 | 34.20 |
| 生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
参考答案:(1)FeCl2,4∶1 , 0.912 g
(2)180 mL
(3)0.105mol<n(Cu)<0.315mol
本题解析:(1)由于向溶液中滴入KSCN溶液,无明显现象可知反应后生成的物质为FeCl2,由于放人盐酸的量为28.00 mL× 1 mol/L=0.028mol,故产生FeCl2的物质的量为0.028/2=0.014mol。其中单质铁分别于盐酸、Fe3O4二者发生反应,①由生成标准状况下的气体134.4 mL,根据电荷守恒可知,混合物中与盐酸发生产生气体的单质铁为0.006mol,②Fe3O4与Fe、HCl共同反应,在该反应中铁元素总量为:0.014mol-0.006mol=0.008mol,且该反应方程式为Fe3O4+8HCl+Fe=4FeCl2+4H2O,通过该反应方程式可知Fe3O4为0.002mol,发生该反应的单质铁为0.002mol。故总的Fe物质的量为0.008mol,Fe3O4为0.002mol。故比例为4∶1。质量为0.002mol×232g/mol +0.008mol×56g/mol =0.912g。
(2)根据三个实验,通过投入粉末质量与产生气体的体积比例关系可知,Ⅰ、Ⅱ为硝酸过量,Ⅲ为粉末过量。可通过实验Ⅲ计算出硝酸的体积。由于假设NO是硝酸的唯一还原产物,且产生的气体的物质的量为6.720L/22.4L·mol-1=0.3mol。则N元素得到电子数为0.3mol×3=0.9mol。由于Ⅲ中混合物质量为34.2g,且n(Fe)∶n(Fe3O4)=4:1,则Fe为0.3mol,Fe3O4为0.075mol,由于氮元素得到电子数共为0.9mol,故溶液中为Fe(NO3)2、Fe(NO3)3两种溶质,计算可知Fe(NO3)2为0.075mol,Fe(NO3)3为0.45mol。故溶液中硝酸根含量为0.075mol×2+0.45mol×3=1.5mol。则该反应中N元素总物质的量为1.5mol+0.3mol=1.8mol。故硝酸的体积为180ml。
(3)27.36g 粉末,根据n(Fe)∶n(Fe3O4)=4:1可知含铁元素0.42mol,由于硝酸过量,产物为硝酸铁,故II反应需用硝酸1.52 mol(硝酸共1.8mol),故II溶液中有Fe3+ 0.42 mol,过量硝酸0.28mol,
3Cu ~ 8HNO3? Cu ~ 2Fe3+
3? 8? 1? 2
nmin? 0.28mol? n? 0.42
nmin=0.105mol? n=0.21mol? nmax =0.21mol+0.105mol=0.315mol
本题难度:一般
3、选择题 下列物质的转化在给定条件下能实现的是( )
①Al2O3
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列物质在常温下可用铁质容器盛放的是
A.亚硫酸
B.浓硫酸
C.浓盐酸
D.胆矾溶液
参考答案:B
本题解析:略
本题难度:简单
5、选择题 要检验久置的FeSO4溶液是否含有Fe2(SO4)3,应选用的试剂是
A.NH4SCN溶液
B.KI溶液
C.氨水
D.Fe粉
参考答案:A
本题解析:略
本题难度:一般