时间:2021-06-11 07:12:22
1、实验题 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下: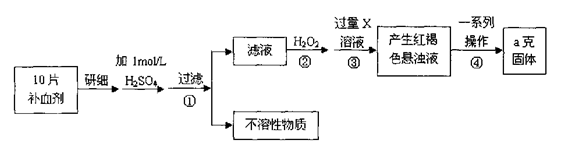 请回答下列问题:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加?,该过程的现象为:?。
(2)步骤②加入过量H2O2的目的:?。
(3)步骤③中反应的离子方程式:?。
(4)步骤④中一系列处理的操作步骤:过滤、?、灼烧、?、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量?g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需?。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是?。
a.稀硝酸? b.稀硫酸? c.稀盐酸? d.浓硝酸
③滴定到终点时的颜色为?色。
(7)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H?2?O的片剂。来补充铁,则正常人每天服需用含?mgFeSO4·7H2O为片剂。
参考答案:(1)氯水(或双氧水、稀硝酸等合理氧化剂)(1分)现象:或溶液由浅绿色变为血红色(1分)?
(2)将Fe2+全部氧化为Fe3+(2分)
(3)Fe3++3OH—→Fe(OH)3↓(或Fe3++3NH3·H2O→Fe(OH)3+3NH4+)(2分)
(4)洗涤、冷却(各1分,共2分)?(5)0.07a(2分)
(6)①250mL容量瓶(1分)②b(2分)③紫(或紫红)(1分)?(7)69.5mg(2分)
本题解析:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量。
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+。检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液由浅绿色变为血红色,说明含有Fe2+。
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水,反应离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+。
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量。
(5)ag固体是氧化铁,则根据铁原子守恒可知,每片补血剂含铁元素的质量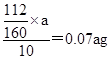 。
。
(6)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需要250mL容量瓶。
②硝酸是氧化性酸,能和亚铁离子反应,生成铁离子,不能用硝酸酸化。高锰酸钾溶液能氧化盐酸生成氯气,不能用盐酸酸化,实验应该用稀硫酸酸化,答案选b。
③高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色。
(7)14mg铁即为FeSO4?7H2O片剂中铁的质量,所以需要FeSO4?7H2O片剂质量为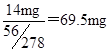
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,贴近高考,有利于激发学生的学习兴趣和学习积极性。清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力。
本题难度:一般
2、选择题 下列实验操作与对应的反应现象或原理正确的一组是(?)
| 选项 | 实验操作 | 现象或原理 |
| A | 取少量KI溶液,先滴加氯水,再加入少量苯,振荡、静置 | 溶液分层,下层呈紫红色 |
| B | 将稀盐酸或氢氧化钠溶液慢慢滴入氢氧化铝胶体中 | 均先沉淀后溶解 |
| C | 将浓硝酸加入盛有铂、金的烧杯中,不反应,加入一定量浓盐酸后,铂、金溶解 | 浓盐酸氧化性强于浓硝酸 |
| D | 将40.0 g NaOH固体溶于1.0 L蒸馏水中配成溶液 | 溶液物质的量浓度为1.0mol﹒L-1 |
参考答案:B
本题解析:A.发生反应:Cl2+2I-=I2+2Cl-。I2容易溶解在苯等有机溶剂中,而苯的密度比水小,难溶于水,所以再加入少量苯,振荡、静置,会看到溶液分层,上层呈紫红色。错误。B. 胶体的表面积大,能吸附电荷。金属氢氧化物的胶体吸附正电荷。胶粒之间有排除力,所以胶体能稳定存在。当向胶体中加入电解质时,胶粒上的电荷被中和发生聚沉现象。若向其中加入稀盐酸或氢氧化钠溶液,由于氢氧化铝是两性氢氧化物,既能与强酸发生反应,也能与强碱发生反应,产物都容易溶解在水中,所以,均先沉淀后溶解现象。正确。C. 将浓硝酸加入盛有铂、金的烧杯中,不反应,加入一定量浓盐酸后,形成王水,能产生新的强氧化剂,所以能够将铂、金溶解。不是浓盐酸氧化性强于浓硝酸。错误。D.溶液的物质的量浓度是用位体积的溶液中溶质的物质的量的多少来表示溶液组成的物理量。不是指溶剂的体积。错误。
本题难度:一般
3、选择题 下列试管实验的方案中,一定能达到实验目的是
A.制备乙酸丁酯:加入正丁醇和乙酸,再滴加几滴浓硫酸,振荡,水浴加热
B.检验甲基橙试液中是否混有微量酚酞:按图所示上升纸上层析法实验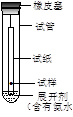
C.检验醛基:加入CuSO4溶液和NaOH溶液各1mL,振荡,加入乙醛溶液,煮沸
D.比较苯酚、乙酸、碳酸的酸性:乙酸和纯碱反应产生的气体通入苯酚钠溶液中
参考答案:B
本题解析:A、制备乙酸丁酯:先加入正丁醇,然后逐滴加入几滴浓硫酸,震荡冷却后在加入乙酸,A不正确;B、甲基橙与酚酞是两种常见的酸碱指示剂,它们在水中和有机溶剂中的溶解度不同,酚酞易溶于酒精而不溶于水;甲基橙易溶于水。当有机溶剂沿滤纸流经混合物的点样时,甲基橙和酚酞会以不同的速度在滤纸上移动,酚酞的移动速度快于甲基橙,形成不同的色斑,内部的黄斑为甲基橙,外部的红色斑为酚酞,从而达到分离的目的,B正确;C、在制备氢氧化铜悬浊液时氢氧化钠应该是过量的,所以选项C不正确;D、乙酸易挥发,生成的CO2气体中含有乙酸,所以在通入到苯酚钠溶液中之前需要除去CO2中的乙酸,D不正确,答案选B。
本题难度:一般
4、选择题 下列说法中,正确的是
A.用标准盐酸滴定待测氢氧化钠溶液浓度,水洗后的酸式滴定管未经标准液润洗,则滴定结果偏低
B.配制0.1mol/LNaOH溶液时,用潮湿的烧杯称量NaOH固体,对配制结果无影响。
C.测定镀锌铁皮镀层厚度实验,当表面镀层反应完后需将铁皮用水洗,然后用酒精灯高温灼烧冷却后称量,以减少实验误差。
D.测定小苏打中Na2CO3含量的方案:取a(g)样品与足量稀硫酸充分反应,逸出的气体用碱石灰吸收,增重b(g)。
参考答案:B
本题解析:A、用标准盐酸滴定待测氢氧化钠溶液浓度,水洗后的酸式滴定管未经标准液润洗,则盐酸浓度降低消耗盐酸溶液的体积增加,滴定结果偏高,A不正确;B、配制0.1mol/LNaOH溶液时,用潮湿的烧杯称量NaOH固体,氢氧化钠质量不变,对配制结果无影响,B正确;C、测定镀锌铁皮镀层厚度实验,当表面镀层反应完后需将铁皮用水洗,然后烘干称量即可,用酒精灯高温灼烧则导致铁被氧化,引起实验误差,C不正确;D、逸出的气体中除了含有CO2外还有水蒸气,D不正确,答案选B。
本题难度:一般
5、选择题 下列有关实验原理或实验操作正确的是
A.用蒸馏水湿润的pH试纸测量某溶液的pH=10
B.用10 mL量筒量取0.50 mol·L-1H2SO4溶液5.50 mL
C.向铁钉上镀铜时,铁钉连接直流电源的正极
D.盛装Na2CO3溶液的试剂瓶要使用胶塞
参考答案:D
本题解析:A.pH试纸测量某溶液的pH时不能湿润。错误。B.10 mL量筒量取溶液的体积时只能估读到小数点后一位。错误。C.向铁钉上镀铜时,镀件铁钉连接直流电源的负极,镀层金属连接在电源的正极上。错误。D.Na2CO3溶液由于水解显碱性,容易与玻璃中的SiO2发生反应产生有粘性的Na2SiO3。若用玻璃塞就会导致玻璃瓶一玻璃塞粘在一起。所以盛装Na2CO3溶液的试剂瓶要使用胶塞。正确。
本题难度:一般