时间:2021-06-11 07:03:31
1、填空题 (1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理上可以设计成原电池的是______.
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2H2(g)+O2(g)=2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为______.
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与如图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:①若X和Y均为惰性电极,a为CuSO4溶液,则阳极的电极反应式为______,电解时的化学反应方程式为______,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为______mol.②若X、Y依次为铜和铁,a仍为CuSO4溶液,且反应过程中未生成Fe3+,则Y极的电极反应式为______
③若用此装置电解精炼铜,______做阳极,电解液CuSO4的浓度______(填“增大”、“减小”或“不变”).
④若用此装置在铁制品上镀铜,铁制品做______,电镀液的浓度______(填“增大”、“减小”或“不变”).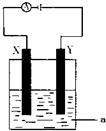
参考答案:(1)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;
故答案为:C;
(2)以KOH溶液为电解质溶液,氢氧燃料碱性电池中,负极上氢气失去电子,负极反应为H2+2OH--2e-=2H2O,
故答案为:H2+2OH--2e-=2H2O;
(3)①电解硫酸铜溶液时,阳极上生成氧气,阴极上生成铜,同时溶液中生成硫酸,所以,阳极电极反应为:4OH--4e-=H2O+O2↑;电池反应式为:2CuSO4+2H2O?通电?.?2Cu+O2↑+2H2SO4,根据铜原子守恒知,氧化铜和铜的比是1:1,所以0.2molCuO能生成0.2mol铜,转移电子的物质的量=0.2mol×2=0.4mol,
故答案为:4OH--4e-=H2O+O2↑;2CuSO4+2H2O?通电?.?2Cu+O2↑+2H2SO4;0.4mol;
②若X、Y依次为铜和铁,a仍为CuSO4溶液,判断,X阴极,Y为阳极,且反应过程中未生成Fe3+,阳极铁失电子生成亚铁离子;Y极电极反应为:Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
③电极精炼铜是粗铜做阳极,精铜做阴极,含铜离子的盐溶液做电解质溶液,粗铜中含有的杂质金属铁、镍、锌等电解过程中也会失电子,所以电解质溶液中铜离子浓度减小,
故答案为:粗铜;减小;
④若用此装置在铁制品上镀铜,依据电镀原理,镀层金属铜做电解池的阳极,待镀物质铁做阴极,电解质溶液是含镀层金属离子铜离子的溶液;电极反应阳极:Cu-2e-=Cu2+;阴极电极反应:Cu2++2e-=Cu,反应电解质溶液浓度基本不变,故答案为:阴极;不变.
本题解析:
本题难度:一般
2、选择题 已知石墨、金刚石燃烧的热化学方程式分别为C(石墨、s)+ O2(g)= CO2(g) ΔH2= -393.5kJ/mol,C(金刚石、s)+ O2(g)= CO2(g) ΔH2= -395.4kJ/mol。关于石墨和金刚石的相互转化,下列说法正确的是
[? ]
A.石墨转化成金刚石是自发进行的过程
B.金刚石转化石墨成金刚石是自发进行的过程
C.相同质量时,石墨比金刚石能量低
D.相同质量时,金刚石比石墨能量低
参考答案:BC
本题解析:
本题难度:一般
3、选择题 已知下列热化学方程式:
Zn(S)+1/2O2(g)=ZnO(S)△H1;Hg(l)+1/2O2(g)=HgO(S)△H2;
则Zn(S)+HgO(S)=Hg(l)+ZnO(S)△H值为( ? )
A.△H2-△H1
B.△H2+△H1
C.△H1-△H2
D.-△H1-△H2
参考答案:C
本题解析:
本题难度:一般
4、选择题 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O?(g)△H=-1?135.7kJ/mol;下列说法正确的是( )
A.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-1?068?kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4+H2O═N2H5++OH-
C.铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,工作一段时间后,KOH溶液的pH将增大
参考答案:C
本题解析:
本题难度:简单
5、选择题 已知:
(1)Zn(s)+?O2(g)===?ZnO(s),ΔH=?-348.3?kJ·mol-1, ?
(2)2Ag(s)+?O2(g)===?Ag2O(s),ΔH=?-31.0?kJ·mol-1,
则Zn(s)+?Ag2O(s)?===?ZnO(s)+?2Ag(s)的ΔH等于
[? ]
A.-317.3?kJ·mol-1?
B.-379.3?kJ·mol-1?
C.-332.8?kJ·mol-1?
D.317.3?kJ·mol-1
参考答案:A
本题解析:
本题难度:简单