时间:2021-06-11 07:03:31
1、选择题 一定条件下用甲烷可以消除氮氧化物(NOx)的污染。已知:
①CH4(g) +4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
下列选项正确的是
[? ]
A.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
B.反应CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)的焓变为△H3,△H3>△H1
C.若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ
D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子的物质的量为3.2 mol
2、简答题 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5?μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO | NO | Cl- 浓度/mol?L-1 4×10-6 6×10-6 2×10-5 4×10-5 3×10-5 2×10-5 |
| 1 2 |
| 1 2 |
3、选择题 已知:
Fe2O3(s)+3/2C(s)== 3/2CO2(g)+2Fe(s);△H=234.1KJ/mol
C(s)+ O2(g)== CO2(g);?△H= -393.5KJ/mol
则4Fe(s)+ 3O2(g)== 2Fe2O3(s)的△H是
[? ]
A.-1648.8KJ/mol
B.-824.4KJ/mol
C.+1648.8KJ/mol
D.-744.7KJ/mol
4、选择题 已知:Fe2O3(s)+C(s)=CO2(g)+2Fe(s),ΔH=+234.1kJ·mol-1
C(s)+O2(g)=CO2(g);ΔH=-393.5kJ·mol-1
则2Fe(s)+ O2(g)=Fe2O3(s)的ΔH是
[? ]
5、简答题 化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.
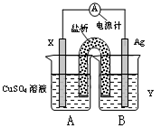
(1)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)?设计的双液原电池,可以提供稳定的电流.装置如图所示,其中盐桥中装有琼脂-饱和KCl溶液.
回答下列问题:
①电极X的材料和电解质溶液Y分别为______、______;
②盐桥中K+移向______(填A或B);
③银电极发生的电极反应为______.
(2)已知:C(s)+O2(g)=CO2(g)△H1=-396.5kJ?mol-1
H2(g)+1/2O2=H2O(g)△H2=-241.8kJ?mol-1
CO(g)+1/2O2(g)=CO2(g)△H3=-283.0kJ?mol-1
根据盖斯定律写出单质碳和水蒸气生成水煤气的热化学方程式:______.
(3)100mL?1.0mol?L-1盐酸与100mL1.0mol?L-1NaOH溶液在量热计中进行中和反应.测得反应后溶液温度升高了6.8℃,已知稀溶液的比热容为4.2kJ/℃?kg-1,则该中和反应的反应热为______.(小数点后面保留一位有效数字)