时间:2021-06-11 06:56:28
1、选择题 某无色溶液既可能是强酸性又可能是强碱性,在该溶液中一定能大量共存的离子是 ( )
A.H+ Na+ NO3- SO42-
B.Na+ CO32- Cu2+Cl-
C.K+ Na+ Cl-SO42-
D.K+ Cl-Ba2+ HCO3-
参考答案:C
本题解析:当溶液呈强碱性时,A中H+不能大量共存;当溶液呈强酸性时,B中CO32-不能大量共存,Cu2+有颜色也不能大量共存;当溶液呈强酸性或强碱性时,D中HCO3-都不能共存。
考点:离子共存
点评:HCO3-在强酸性和强碱性溶液中都不能大量共存。
本题难度:困难
2、选择题 下列各溶液中一定能大量共存的离子组是
[? ]
A.加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+
B.使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl-
C.常温下,c(H+)=10-14mol/L的溶液中:Na+、AlO2-、S2-、SO32-
D.常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HCO3-、Ca2+
参考答案:C
本题解析:
本题难度:一般
3、选择题 将足量NO2通入下列各溶液中,所含离子还能大量共存的是(? )
A.Fe2+、CH3COO-、Na+、SO42-
B.K+、Ca2+、HCO3-、Cl-
C.Al3+、NH4+、Cl-、NO3-
D.K+、Na+、SiO32-、AlO2-
参考答案:C
本题解析:NO2 通入溶液中会与水反应生成硝酸,使溶液呈强酸性和强氧化性。所以A选项中Fe2+ 容易被氧化、CH3COO- 与H+生成弱电解质而不能大量共存,A错误;HCO3-与H+ 不能大量共存,B错误;C可以大量共存;D中SiO32-、AlO2- 与H+ 生成弱酸不能大量共存,D错误;故选C。
本题难度:一般
4、实验题 (16分)某化学兴趣小组在课外活动中,对某溶液进行了三次检验,每次检验结果如下表所示,请回答下列问题。
| 检验次数 | 溶液中检验出的物质 |
| 第一次 | 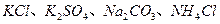 |
| 第二次 | 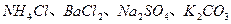 |
| 第三次 | 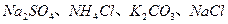 |
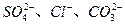 ,进行下列实验:(填写下列空白)
,进行下列实验:(填写下列空白)步 骤 骤 | 实验操作 | 预期现象及结论 |
| 1 | 向溶液中滴加?(填化学式)溶液至过量 | ? |
| 2 | __________________________ __________________________ | ? |
| 3 | 过滤,再向滤液中加入? ________(填化学式)溶液 | ? |
参考答案:

本题解析:略
本题难度:一般
5、填空题 某溶液中可能有下列阴离子:SO42-、CO32-、Cl-.
(1)当溶液中存在大量H+时,溶液中不能大量存在的离子是______.
(2)当溶液中存在大量的Ba2+时,溶液中不能大量存在的离子是______.
(3)当溶液中存在大量______和______离子时,上述阴离子都不能大量存在.
参考答案:(1)当溶液中存在大量H+时,与H+反应生成气体的CO32-离子不能大量存在,故答案为:CO32-;
(2)当溶液中存在大量的Ba2+时,与Ba2+反应生成沉淀的CO32-、SO42-离子不能大量存在,故答案为:CO32-、SO42-;
(3)当溶液中存在大量的Ba2+时,CO32-、SO42-离子不能大量存在,当溶液中存在Ag+离子时,与Ag+反应生成沉淀的Cl-离子不能大量存在,故答案为:Ba2+;Cl-.
本题解析:
本题难度:一般