时间:2021-06-11 06:56:28
1、选择题
A.K+、Na+、HSO 、Cl-
、Cl-
B.Na+、Ba2+、AlO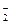 、NO
、NO
C.NH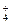 、K+、Cl-、NO
、K+、Cl-、NO
D.K+、Na+、ClO-、S2-
2、填空题 某透明溶液,可能含有(大量存在)下面离子的几种:(阳离子组:Cu2+、Ba2+、Mg2+、H+;阴离子组:Cl-、OH-、N
3、选择题 下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.H3O+、NO3-、Fe2+、Na+
B.Ag+、NO3-、Cl-、K+、
C.K+、Ba2+、OH-、SO42-
D.Cu2+、NH4+、Br-、OH-
4、选择题 下列能在溶液中大量共存的一组离子是( )
A.K+、Na+、NO3-、ClO-
B.Fe3+、H+、I-、HCO3-
C.NH4+、Ag+、OH-、Cl-
D.Fe2+、Mg2+、SO42-、MnO4-
5、选择题 常温下,对于下列电解质溶液,说法正确的是(? )
A.pH=1的溶液中,Fe3+、I-、NO3-、K+可以大量共存
B.在c(SO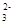 )=0.1 mol·L-1的溶液中,Na+、Cl-、H+、Ca2+可以大量共存
)=0.1 mol·L-1的溶液中,Na+、Cl-、H+、Ca2+可以大量共存
C.工业上用过量的NaOH溶液吸收SO2:SO2 + OH- ="=" HSO3-
D.将AlCl3溶液滴入NaOH溶液中反应的离子方程式:Al3+ + 4OH- = AlO2- + 2H2O