时间:2021-06-11 06:56:28
1、选择题 向含有下列离子的溶液中分别加入Na2O2(忽略溶液体积的变化),离子浓度基本不变的是
A.AlO2-
B.Na+
C.Fe2+
D.HCO3-
参考答案:A
本题解析:过氧化钠与溶液中的水反应,生成氢氧化钠与氧气,Fe2+与OH-反应生成Fe(OH)2,Fe(OH)2与氧气和水反应生成Fe(OH)3,HCO3-+OH-= CO32-+H2O,所以AlO2-浓度基本不变,Na+浓度增大,Fe2+、HCO3-浓度减小,选A。
考点:考查Na2O2的性质。
本题难度:一般
2、选择题 下列离子在指定溶液中一定能大量共存的是
[? ]
①加入Al能放出H2的溶液中:Fe2+、Al3+、NO3-、Cl-、S2-
②在PH =11的溶液中:Na+、[Al(OH)4]-、NO3-、S2-、SO42-
③由水电离的c(H+) =10-12mol/L的溶液中:Cl-、HCO3-、NO3-、NH4+、F-
④使石蕊试剂变红的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
A.②④
B.①②④
C.①③④
D.①②
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列各组离子中,在碱性溶液中共存,且加入盐酸过程中,会产生气体和沉淀的是(?)
A.Na+、NO3-、AlO2-、SO42-
B.Na+、NO3-、SiO 32-、K+
32-、K+
C.K+、Cl-、AlO2-、CO32-
D.K+、Cl-、HCO3-、Ca2+
参考答案:C
本题解析:略
本题难度:简单
4、计算题 (9分) 已知有关物质的氧化性强弱顺序为:浓硫酸>Fe3+>H+>Fe2+。称得 60 g 铁粉与100 mL 浓硫酸在加热的条件下反应,反应最终有固体剩余,共收集到标准状况下气体22.4 L,气体的质量为39.2 g。试回答以下问题:(又知:2Fe 3++ Fe = 3Fe2+)
(1)在加热的条件下开始反应到最终有固体剩余,还涉及到的化学方程式有:
_______________________________________________________________________;
(2)求浓硫酸的物质的量浓度;
(3)反应最终剩余固体的质量。(写出简单的计算过程)
参考答案:
(1)2Fe + 6H2SO4(浓)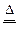 ?Fe2(SO4)3?+ 3SO2?+ 6H2O? (2分)
?Fe2(SO4)3?+ 3SO2?+ 6H2O? (2分)
Fe + H2SO4 = H2?+FeSO4? (2分)
(2)16 mol/L? (3分)
(3) 4 g? (2分)
本题解析:略
本题难度:简单
5、选择题 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的
关系如图所示。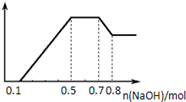
则下列说法正确的是
A.溶液中一定不含CO32-,可能含有SO42-和NO3-
B.溶液中的阳离子只有H+、Mg2+、Al3+
C.溶液中n(NH4+)="0.2mol"
D.n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1
参考答案:C
本题解析:加入锌粒,产生无色无味的气体,则该溶液含有H+,不含CO32?;根据图像白色沉淀的量先增加,然后不变,然后溶解一部分,说明该溶液含Al3+、Mg2+、NH4+,不含Fe3+,SO42?与NO3?至少含有一种,故A、B错误;加入NaOH0.5mol至0.7mol时与NH4+反应,NH4++OH?=NH3?H2O,则NH4+物质的量为0.2mol,故C正确;D、加入NaOH0~0.1mol,与H+反应,则H+为0.1mol,加入NaOH0.7mol~0.8mol,与Al(OH)3反应,Al(OH)3+OH?=[Al(OH)4]?,则Al(OH)3、Al3+物质的量为0.1mol,根据Al3++3OH?=Al(OH)3↓,生成Al(OH)3需要NaOH0.3mol,加入NaOH0.1至0.5mol,生成Al(OH)3、Mg(OH)2,则生成Mg(OH)2需要NaOH物质的量为:0.4mol-0.3mol=0.1mol,根据Mg2++2OH?=Mg(OH)2↓,可得Mg2+物质的量为0.05mol,所以n(H+)∶n(Al3+)∶n(Mg2+) = 2∶2∶1,故D项错误。
考点:本题考查离子反应、图像的分析、化学计算。
本题难度:困难