时间:2021-06-11 06:55:04
1、选择题 室温下有下列四种溶液:①0.1mol·L-1氨水?②0.1mol·L-1NH4Cl溶液?③含有0.1mol·L-1
盐酸和0.1mol·L-1 NH4Cl的混合溶液?④含有0.1mol·L-1 NaOH溶液和0.1 mol·L-1氨水的混合
溶液,四种溶液中c(NH4+)由小到大排列正确的是
A.②③④①
B.④①②③
C.①④②③
D.③②①④
参考答案:B
本题解析:氨水是弱碱,存在电离平衡;氯化铵是强电解质,完全电离,但氯化铵水解显酸性;盐酸的存在能抑制氯化铵水解;氢氧化钠的存在,能抑制氨水的电离,所以答案选B。
本题难度:一般
2、填空题 21、(4分)某同学设计用AlCl3溶液和Na2S溶液反应制取硫化铝(Al2S3)固体,你认为他能达到目的吗??原因是(用离子方程式表示):?。配制Na2S溶液时,为了防止水解,常向溶液中加入少量?,用离子方程式表示Na2S的水解?。
参考答案:(每空1分)不能,2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑,
NaOH,S2-+H2O HS—+OH—
HS—+OH—
本题解析:略
本题难度:简单
3、选择题 0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是
A.c(K+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
B.c(K+)+ c(S2-) = 0.3mol/L
C.c(K+)=c(S2-)+c(HS-)+c(H2S)
D.c(OH-)=c(H+)+c(HS-)+2c(H2S)
参考答案:D
本题解析:A、根据电荷守恒可知c(K+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),A不正确;B、根据物料守恒可知c(K+)=2c(S2-)+2c(HS-)+2c(H2S)=0.2mol/L,所以c(K+)+ c(S2-)<0.3mol/L,B不正确;C、根据物料守恒可知c(K+)=2c(S2-)+2c(HS-)+2c(H2S)=0.2mol/L,C不正确;D、根据质子守恒可知c(OH-)=c(H+)+c(HS-)+2c(H2S),D正确,答案选D。
本题难度:一般
4、计算题 室温时,若0.1mol·L-1NaX溶液的pH=9,该溶液中发生水解反应的X-占全部X-的物质的量分数为多少?
参考答案:0.01%
本题解析:pH=9,则c(OH-)=10-5mol·L-1,设溶液体积为1L,水解的X-物质的量为x,由水解方程式知:
X-+H2O HX+OH-
HX+OH-
x=n(OH-)=10-5mol
所以发生水解反应的X-占全部X-的物质的量分数为: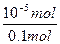 ×100%=0.01%
×100%=0.01%
本题难度:简单
5、选择题 已知某温度下0.1mol/L的NaHB(强电解质)溶液中c(H+)>c(OH-),则下列关系一定正确的是(? )
A.c(Na+)=c(HB-)+2c(B2-)+c(OH-)
B.c(Na+)=0.1mol/L≥c(B2-)
C.c(H+)·c(OH-)=10-14
D.溶液的PH等于1
参考答案:B
本题解析:由NaHB是强电解质和c(H+)>c(OH-),但并不知道HB-是完全电离还是部分电离,只知可能完全电离或部分电离时应电离程度大于水解程度,故B正确,而D错误;依据电荷守恒知A错;又C项中某温度并非是常温。
本题难度:一般