时间:2021-06-11 06:37:40
1、选择题 下列液体均处于25℃,有关叙述不正确的是
A.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
B.某物质的溶液中由水电离的c(H+)=1×l0-12mol·L-1,则该物质一定是强碱溶液
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同
D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) < c(CH3COO-)
2、选择题 下列有关AgCl沉淀的溶解平衡的说法中,不正确的是
[? ]
A.AgCl沉淀生成和溶解不断进行,但速率相等
B.AgCl难溶于水?,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低
3、选择题 在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2 Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是 ( )
Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是 ( )
A.加MgSO4
B.加HCl溶液
C.加NaOH
D.加少量水
4、选择题 下列对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的原因解释中正确的有
[? ]
A.Mg(OH)2的Ksp大于MgCO3的Ksp,且在水中发生了沉淀转化
B.Mg(OH)2的Ksp小于MgCO3的Ksp,且在水中发生了沉淀转化
C.MgCO3电离出的CO32-发生水解,使水中c(OH-)减小,对Mg(OH)2的沉淀溶解平衡而言,Qc<
D.MgCO3电离出的CO32-发生水解,使水中c(OH-)增大,对Mg(OH)2的沉淀溶解平衡而言,Qc>Ksp,生成 Mg(OH)2沉淀
5、选择题 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如下图所示。据图分析,下列判断错误的是 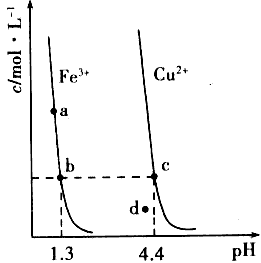
[? ]
A.Ksp[Fe(OH)3]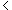 Ksp[Cu(OH)2]
Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和