时间:2021-06-11 06:37:40
1、选择题 硫酸锶(SrSO4)在水中的溶解平衡曲线如图。下列说法正确的是( )
A.温度一定时,Ksp(SrSO4)随 的增大而减小
的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最大
C.283K时a点对应的溶液是不饱和溶液
D.283K下SrSO4饱和溶液升温到363K后变为不饱和溶液
参考答案:BC
本题解析:溶度积常数只与温度有关,A错误。根据图像可判断,当 相同时,温度为313K时锶离子的浓度最大,因此选项B正确。A点不位于溶解度曲线上,所以是不饱和溶液,C正确。因为当
相同时,温度为313K时锶离子的浓度最大,因此选项B正确。A点不位于溶解度曲线上,所以是不饱和溶液,C正确。因为当 相同时,温度为363K时锶离子的浓度最小,所以283K下SrSO4饱和溶液升温到363K后将有晶体形成,溶液还是饱和溶液。答案选BC。
相同时,温度为363K时锶离子的浓度最小,所以283K下SrSO4饱和溶液升温到363K后将有晶体形成,溶液还是饱和溶液。答案选BC。
本题难度:简单
2、简答题 碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业.一种制备MnCO3的生产流程如图所示.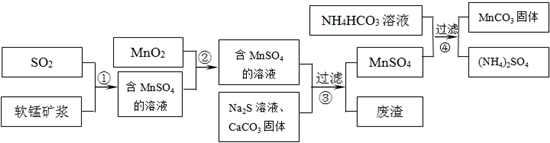
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 开始沉淀pH 2.7 7.6 8.3 完全沉淀pH 3.7 9.6 9.8 |
| 物质 | MnS | CuS | PbS Ksp 2.5×10-13 6.3×10-36 8.0×10-28 |
参考答案:(1)软锰矿浆是二氧化锰,MnSO4溶液水解先酸性,根据2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.Fe3+可将SO2氧化为硫酸,故答案为:小;工业制备硫酸;?
(2)MnO2可将Fe2+氧化成Fe3+,Fe3+完全沉淀的pH较Fe2+低;故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;使Fe2+?转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀);
(3)碳酸钙与溶液中的H+反应,使溶液中的PH升高,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀,故答案为:与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀;
(4)加入稍过量的NH4HCO3能提高MnSO4的装化率,使MnCO3沉淀完全,溶液的pH不过低,H+可与MnCO3,NH4HCO3反应,故答案为:使MnCO3沉淀完全;MnCO3沉淀量少,NH4HCO3与酸反应.(或MnCO3、NH4HCO3与酸反应溶解);
(5)锰矿与煤炭粉混合,焙烧生成二氧化硫,污染空气,而工艺A不仅不产生二氧化硫,且能生产硫酸,故答案为:节约能源、治理含SO2的工业废气等.
本题解析:
本题难度:一般
3、选择题 已知25℃时,电离常数Ka(HF)=3.6×10-4?mol/L.溶度积常数Ksp(CaF2)=1.46×10-10.现向1?L?0.2?mol/L?HF溶液中加入1?L?0.2?mol/L?CaCl2溶液.则下列说法不正确的是
[? ]
A.25℃时,0.1?mol/L?HF溶液中pH>1
B.Ksp(CaF2)随温度的变化而变化
C.氟化钙和氟化氢都是弱电解质
D.该体系中有CaF2沉淀产生
参考答案:C
本题解析:
本题难度:一般
4、选择题 已知CuSO4溶液分别与Na2CO3、Na2S溶液的反应情况如下:?据此判断,下列几种物质Ksp大小的比较中正确的是?
[? ]
A.Cu(OH)2<CuS?<CuCO3?
B.CuS?<Cu(OH)2<CuCO3?
C.CuCO3<Cu(OH)2<CuS?
D.CuCO3?<CuS?<?Cu(OH)2
参考答案:B
本题解析:
本题难度:一般
5、选择题 已知PbI2的Ksp=7.0×10-9,将1.0×10-2 mol/L的KI与Pb(NO3)2溶液等体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为(mol/L)?
[? ]
参考答案:A
本题解析:
本题难度:一般