时间:2021-06-11 06:28:58
1、填空题 (1)用18mol/L浓硫酸配制100mL?1.0mol/L的稀硫酸,若实验仪器有:
A.100mL量筒?B.玻璃棒 ?C.托盘天平 ?D.50mL容量瓶
E.10mL量筒 ?F.胶头滴管 ?G.50mL烧杯 ?H.100mL容量瓶
实验时必须选用的仪器是(填入字母)______
(2)在配制过程中,下列操作不正确的是______
A.使用容量瓶前需检查它是否漏水
B.容量瓶用蒸馏水洗净后,一定要干燥后再使用
C.配制溶液时,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水至刻度线
D.定容后盖好瓶塞,反复上下颠倒,摇匀
(3)若实验时遇到下列情况,将使所配溶液的浓度 (填“偏高”、“偏低”或“无影响”)
A.定容时俯视读数______?B.未将洗涤液转入容量瓶______
C.洗涤量筒,并将洗涤液转入容量瓶______.
参考答案:(1)配制一定物质的量浓度的溶液所需的仪器:天平、烧杯、胶头滴管、玻璃棒、量筒(浓硫酸稀释前后,溶质的物质的量不变,设需要浓硫酸的体积是V,则18mol/L×V=0.1L×1.0mol/L,解得V=5.6mL,应用10mL量筒,100mL量筒误差较大)、一定规格的容量瓶,故答案为:BEFGH;
(2)A.容量瓶使用前应检验是否漏水,故A正确;
B.最后需要有蒸馏水定容,容量瓶不干燥无影响,故B错误;
C.量筒量取后应先在小烧杯中稀释,然后将洗涤液一并转入容量瓶,故C错误;
D.定容后需要上下摇匀,故D正确.
故答案为:BC;
(3)A.定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏大;
B.未将洗涤液转入容量瓶,移入容量瓶中溶质的实际质量减小,溶液浓度偏低;
C.量筒不需要洗涤,否则会使移入容量瓶中溶质的实际质量减大,溶液浓度偏高;
故答案为:偏高;偏低;偏高.
本题解析:
本题难度:一般
2、选择题 若NA表示阿伏加德罗常数,下列说法正确的是?(?)
A.1 mol SiO2晶体中含有NASiO2个分子
B.7.8 g Na2O2中含有的离子总数目为0.4NA
C.标准状况下2.24L苯含有的碳原子数目为0.6NA
D.12.8g Cu与足量HNO3反应生成NO和NO2,转移电子数目为0.4NA’
参考答案:D
本题解析:A错,SiO2晶体为原子晶体,无分子;B错,7.8 g Na2O2中含有的离子总数目为0.3NA;C错,标准状况下苯不是气体;D正确;
本题难度:一般
3、选择题 物质的量相同的甲烷(CH4)和氨气(NH3),一定相同的量是( )
A.质量
B.体积
C.质子数
D.原子数
参考答案:C
本题解析:
本题难度:一般
4、简答题 (1)下列四种物质:①6gH2②0.56molNH3③1.204×1024个氯化氢分子④标准状况下,6.72LCH4 其中物质的量最大的是______,所含H原子数最少的是______.
(2)写出Cu与FeCl3溶液反应的化学方程式______(标出电子转移的方向和数目).该反应的工业用途是______.
(3)
高温高压 |
参考答案:(1)①6gH2的物质的量=6g2g/mol=3mol,n(H)=6mol;
②0.56molNH3分子中n(H)=0.56mol×3=1.68mol;
③1.204×1024个氯化氢分子的物质的量=1.204×10246.02×1023mol-1=2mol,n(H)=2mol,
④标准状况下,6.72LCH4 的物质的量=6.72L22.4L/mol=0.3mol,n(H)=1.2mol,
故物质的量最大的是①,所含H原子数最少的是④,
故答案为:①;④;
(2)Cu与氯化铁反应生成氯化亚铁与氯化铜,标出电子转移的方向和数目为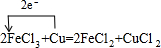 ,工业上常用于制作印刷电路板,
,工业上常用于制作印刷电路板,
故答案为: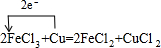 ;制作印刷电路板;
;制作印刷电路板;
(3)氮气与氢气在高温高压、催化剂条件下生成氨气,反应方程式为:N2+3H2催化剂.高温高压2NH3,
答:工业合成氨的方程式为N2+3H2催化剂.高温高压2NH3.
本题解析:
本题难度:简单
5、选择题 下列溶液中,溶质的物质的量浓度为1mol/L的是( )
A.含Na+为2mol的Na2SO4溶液
B.将80gSO3溶于水并配成1L的溶液
C.将0.5mol/L的某饱和溶液100mL,加热蒸发掉50g水后的溶液
D.将58.5gNaCl溶于1L水所得的溶液
参考答案:A、溶液体积未给出,无法计算钠离子浓度,故A错误;
B、根据硫原子守恒可知n(H2SO4)=n(SO3)=80g80g/mol=1mol,所以溶液浓度为1mol/L,故B正确;
C、饱和溶液,蒸发掉水后,剩余溶液仍为饱和溶液,浓度不变(挥发性溶质会较低),故C错误;
D、将58.5gNaCl溶于水配成1L溶液,浓度为1mol/L,故D错误.
故选B.
本题解析:
本题难度:简单