时间:2021-06-11 06:28:58
1、选择题 下列叙述中正确的是
①标准状况下,1 L HCl和1 L H2O的物质的量相同
②标准状况下,1 g H2和14 g N2的体积相同
③28 g CO的体积为22.4 L
④两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑤在同温同体积时,气体物质的物质的量越大,则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③
B.②⑤⑥
C.②③⑥
D.④⑤⑥
2、简答题 将3.22g芒硝(Na2SO4?10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为多少克?
3、选择题 配制一定物质的量浓度的NaCl溶液时,造成浓度偏低的原因可能是( )
A.定容摇匀后,有少量溶液外流
B.定容时,俯视液面
C.称量时,在天平托盘上放上称量纸,将NaCl固体放在纸上称量
D.溶解NaCl的烧杯未洗涤
4、选择题 下列有关说法正确的是(?)
A.9.2 g NO2气体中含有分子数目为0.2NA
B.标准状况下,2.24 L SO3中含有氧原子数目为0.3NA
C.2 g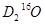 中含中子、质子、电子数目均为NA
中含中子、质子、电子数目均为NA
D.标准状况下2.24 L Cl2通入足量水中或NaOH溶液中,转移电子数目均为0.1NA
5、选择题 用NA表示阿伏伽德罗常数的数值,下列说法正确的是
A.标准状况下,11.2LH2O所含的水分子数目为0.5NA
B.16gO2和O3的混合气体中所含的氧原子数目为NA
C.1.00mol/LNa2CO3溶液中所含Na+的数目为2NA
D.0.1molZn与含0.1molHCl的盐酸充分反应,产生H2数目为0.2NA