时间:2021-06-11 06:08:43
1、选择题 向三份0.lmol/L NaHCO3溶液中分别加入少量冰醋酸、Ca(OH)2、NaA1O2固体(忽略溶液体积变化),则溶液中CO32-浓度的变化依次为(?)
A.减小、减小、增大
B.减小、增大、增大
C.增大、减小、减小
D.减小、减小、减小
参考答案:
A
本题解析:
本题考查电离平衡。 NaHCO3溶液中存在平衡:HCO3- H++CO32-,加入冰醋酸,H+浓度增大,平衡逆向移动,CO32-的浓度减小,加入Ca(OH)2,H+浓度减小,平衡右移,但是Ca2+与CO32-生成CaCO3沉淀,CO32-浓度减小,加入NaAlO2,发生反应H++AlO2-+H2O=Al(OH)3↓,H+减小,平衡右移,CO32-浓度增大,A项正确。
H++CO32-,加入冰醋酸,H+浓度增大,平衡逆向移动,CO32-的浓度减小,加入Ca(OH)2,H+浓度减小,平衡右移,但是Ca2+与CO32-生成CaCO3沉淀,CO32-浓度减小,加入NaAlO2,发生反应H++AlO2-+H2O=Al(OH)3↓,H+减小,平衡右移,CO32-浓度增大,A项正确。
本题难度:一般
2、选择题 体积相同,pH相同的 ①稀盐酸 ②稀硫酸 ③稀醋酸,分别用同物质的量浓度的NaOH溶液完全中和时,所消耗的NaOH溶液的体积关系正确的是
A.②=①>③
B.②>①>③
C.②<①=③
D.③>②=①
参考答案:D
本题解析:体积相同,pH相同的 ①稀盐酸 ②稀硫酸 ③稀醋酸,因为稀醋酸是弱酸,部分电离,故醋酸的物质的量浓度最大,故等体积消耗的NaOH溶液的体积最多;pH相同的 ①稀盐酸 ②稀硫酸,两者均为强电解质,c(H+)相同,故消耗NaOH溶液的体积相同,故D项正确。
考点:弱电解质电离。
本题难度:一般
3、选择题 常温下,0.1mol?L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
A.该溶液中水电离出的c(H+)=1×10-10mol?L-1
B.该溶液中c(H+)+c(A-)+c(HA)=0.1mol?L-1
C.该溶液与0.05mol?L-1NaOH溶液等体积混合后:c(A-)>c(Na+)>c(OH-)>c(H+)
D.向该溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
参考答案:A、溶液中c(OH-)/c(H+)=1×10-8,Kw=C(H+)?C(OH-)=1×10-14,两式中的氢离子浓度是溶液中酸电离出的,氢氧根离子浓度是水电离出的,联立解得C(H+)=0.001mol/L,确定为弱酸溶液,所以溶液中C(OH-)=10-11mol/L,即水电离出的氢离子浓度为10-11mol/L;故A错误;
B、0.1mol?L-1某一元酸(HA)溶液中存在电离平衡,所以根据物料守恒可知c(A-)+c(HA)=0.1mol?L-1,所以c(H+)+c(A-)+c(HA)=0.1mol?L-1是错误的,故B错误;
C、0.1mol?L-1某一元酸(HA)溶液与0.05mol?L-1NaOH溶液等体积混合后反应,反应后的溶液为等浓度的酸HA和盐NaA的混合液,溶液中一定存在电荷守恒;[H+]+[Na+]=[OH-]+[A-],按照选项中的离子浓度大小,若c(A-)>c(Na+),根据电荷守恒应有c(OH-)<c(H+),故C错误;
D、通过计算可知酸为弱酸存在 电离平衡HA?H++A-,加水稀释促进电离,氢离子浓度减小,加入一定量NaA晶体,溶解生成的A-离子抑制了酸的电离,氢离子浓度减小,根据温度一定时溶液中氢离子浓度与氢氧根离子浓度乘积为常数,加入水和加入一定量NaA晶体,使氢离子浓度减小,氢氧根离子浓度增大,故D正确;
故选D.
本题解析:
本题难度:一般
4、选择题 下列实验过程中产生的现象与对应的图形正确的是( )
A.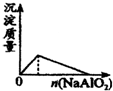
盐酸中加入NaAlO2溶液
B.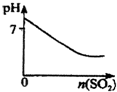
SO2气体通入溴水中
C.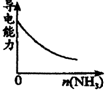
氨气通入醋酸溶液中
D.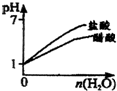
pH=1的醋酸和盐酸分别加水稀释
参考答案:A、在盐酸溶液中加入NaAlO2,发生反应分别为AlO2-+4H+═Al3++2H2O,Al3++3AlO2-+6H2O═4Al(OH)3↓,反应开始时没有沉淀生成,故A错误;
B、SO2气体通入溴水中,发生反应Br2+SO2+2H2O═H2SO4+2HBr,反应后溶液酸性增强,pH减小,故B正确;
C、氨气通入醋酸溶液中,反应生成强电解质醋酸铵,溶液导电能力增强,故C错误;
D、醋酸为弱酸,加水稀释时进一步电离,pH变化较盐酸小,故D正确.
故选BD.
本题解析:
本题难度:简单
5、选择题
A.1.0×10-7 mol·L-1
B.1.0×10-6 mol·L-1
C.1.0×10-2 mol·L-1
D.1.0×10-12 mol·L-1
参考答案:CD
本题解析:考查学生对不同条件下水电离程度的认识,同时考查学生思维的严密性。先分析pH=12的溶液中c(H+)、c(OH-)的大小。由c(H+)=10-pH得:
c(H+)=1.0×10-12 mol·L-1
c(OH-)=1.0×10-2 mol·L-1
再考虑溶液中的溶质:可能是碱,也可能是强碱弱酸盐。
最后进行讨论:
(1)若溶质为碱,则溶液中的H+都是水电离生成的:
c水(OH-)=c水(H+)=1.0×10-12 mol·L-1
(2)若溶质为强碱弱酸盐,则溶液中的OH-都是水电离生成的:
c水(OH-)=1.0×10-2 mol·L-1
本题难度:一般