时间:2021-06-11 06:08:43
1、选择题 常温下,下列有关物质的量浓度关系正确的是(?)
A.等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH
B.pH相同的溶液中:c(Na2CO3)<c(NaHCO3)
C.在Na2SO3溶液中:c(Na+)= 2c(SO32-)+ c(HSO3-)+ c(OH-)
D.0.1mol·L-1NaHS溶液中:c(Na+)= c(HS-)
参考答案:B
本题解析:HCl是强酸,醋酸是弱酸,等浓度的两种酸氢离子的浓度前者大,因此对水电离的抑制作用较大,因此水电离出的c(H+):HCl<CH3COOH ,A错误;根据越弱越水解的原理,等浓度时碳酸钠的水解程度大于碳酸氢钠,因此若pH相同,则c(Na2CO3)<c(NaHCO3),B正确;C中式子不满足电荷守恒和物料守恒式,C错误;HS-离子发生水解,所以c(Na+)>c(HS-),D错误;故选B。
本题难度:一般
2、选择题 下列有关说法正确的是 ( )
A.TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加
B.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
C.pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
参考答案:A
本题解析:A、根据△G=△H—T·△S可知,△G<0时反应自发。如果TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加,即△S>0,A正确;B、氯化钠是强酸强碱盐,不水解,溶液显中性。醋酸铵是弱酸弱碱盐,酸根离子与铵根离子水解程度相同,溶液显中性,但促进水的电离,B不正确;C、pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为弱碱,碱过量,溶液显碱性,C不正确;D、Na2CO3溶液中加入少量Ca(OH)2固体生成碳酸钙沉淀和氢氧化钠,CO32-水解程度减小,但溶液的碱性增强,pH增大,D不正确,答案选A。
考点:考查反应自发性、水的电离、盐类水解以及溶液酸碱性判断
本题难度:一般
3、简答题 如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍;______.
参考答案:氯化氢是强电解质,在其水溶液里完全电离,所以盐酸溶液中,C(H+)=C(HCl),醋酸是弱电解质,在其水溶液里只有部分电离,所以C(H+)<C(CH3COOH),所以如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度大于醋酸的二倍,故答案为:×.
本题解析:
本题难度:一般
4、填空题 (8分)实验表明,液态时,纯硫酸的电离能力强于硝酸,纯硫酸的导电性也显著强于纯水。又知液态纯酸都像水那样进行自身电离(H2O+H2O H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
(1)纯硫酸在液态时自身电离的方程式是 。
(2)25 ℃时,液态纯硫酸的离子积常数K(H2SO4) 1×10-14(填“>”“<”或“=”)。
(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是 ,这是因为混合酸中不仅存在硫酸和硝酸各自电离的两个电离平衡,而且还因硫酸的酸性大于硝酸,又在无水条件下,混合酸中必然发生 (写离子方程式)反应而造成的。
参考答案:(1)2H2SO4 H3SO
H3SO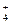 +HSO
+HSO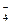
(2)>
(3)HSO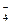 H++NO
H++NO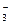
本题解析:
本题难度:简单
5、选择题 下列溶液中除存在水分子外,还存在其它分子的是( )
A.稀硫酸溶液
B.氢氧化钠溶液
C.醋酸溶液
D.氯化钠溶液
参考答案:溶液中除存在水分子外,还存在其它分子,说明溶质是弱电解质,在水溶液里存在电离平衡,
A.硫酸是强电解质,在水溶液里完全电离,所以稀硫酸中不存在溶质分子,故A错误;
B.氢氧化钠是强电解质,在水溶液里完全电离,所以氢氧化钠溶液中不存在溶质分子,故B错误;
C.醋酸是弱电解质,在水溶液里部分电离,醋酸在水溶液里存在电离平衡,所以溶液中还存在醋酸分子,故C正确;
D.氯化钠是强电解质,在水溶液里完全电离,所以氯化钠溶液中不存在溶质分子,故D错误;
故选C.
本题解析:
本题难度:简单