时间:2021-06-11 06:00:09
1、选择题 下列反应的离子方程式书写正确的是
A.用醋酸溶液除水垢:CaCO3+2H+==Ca2++H2O+CO2↑
B.向FeBr2溶液中通入足量C12:Fe2++2Br一+C12==Fe3++Br2+2C1一
C.向Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]一+CO2==Al(OH)3↓+HCO3一
D.向Ba(OH)2溶液滴加NaHSO4溶液至中性:H++SO42-+Ba2++OH一==BaSO4↓+H2O
参考答案:C
本题解析:A.醋酸是弱酸,应该写化学式,离子方程式是:CaCO3+2CH3COOH==Ca2++2CH3COO -+H2O+CO2↑,错误;B.不符合物质的组成,向FeBr2溶液中通入足量C12,反应的离子方程式是:2Fe2++4Br一+3C12==2Fe3++2Br2+6C1一,错误;C.符合反应事实,拆符合离子方程式的原则,正确;D.不符合微粒的个数比例关系,向Ba(OH)2溶液滴加NaHSO4溶液至中性的离子方程式是:2H++SO42-+Ba2++2OH一==BaSO4↓+2H2O,错误。
考点:考查离子方程式的正误判断的知识。
本题难度:困难
2、选择题 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。请根据图像推断,下列说法中不正确的是(已知HCO3-与AlO2-在溶液中不能共存)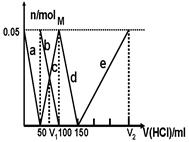
A.M点时生成的CO2为0 mol
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2
C.V1:V2=1:4
D.a段表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓
参考答案:B
本题解析:从题意可知盐酸会先与偏铝酸根离子反应,这是因为若盐酸先与碳酸根离子反应会生成碳酸氢根离子,而题目告诉我们碳酸根离子与偏铝酸根离子不能共存。因此D选项是正确的。A选项在M点说明碳酸根离子已经完全转化为了碳酸氢根离子,没有气体放出。因此在M点时生成的CO2为0 mol; 所以A选项是正确的。C选项从图表中可知V1=50+25=75ml V2=150+150=300ml所以C选项也是正确的。B选项从图形上看,偏铝酸根离子消耗了50ml的盐酸,而碳酸根离子生成碳酸氢根离子消耗了50ml,因此它们消耗盐酸的量相同,所以原混合溶液中的CO32-与AlO2-的物质的量之比为1:1
考点:考查物质的量在化学实验中的应用的相关计算以及离子共存的相关知识点
本题难度:困难
3、选择题 下列表示对应化学反应的离子方程式正确的是
A.向FeCl3溶液中加入Mg(OH)2: 3Mg(OH)2+2Fe3+ ="=" 2Fe(OH)3 +3 Mg2+
B.草酸使酸性KMnO4溶液褪色: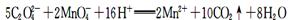
C.往NaHS04溶液中滴加Ba(OH)2至溶液呈中性: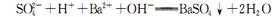
D.向NaCl0溶液中通人少量的CO2:CO2 +2C1O-+H2O ="=" CO32-+ 2 HC1O已知Ka1(H2 CO3)>Ka( HC1O)>Ka2(H2 CO3)
参考答案:A
本题解析:A、向FeCl3溶液中加入Mg(OH)2,则铁离子与氢氧根离子反应生成氢氧化铁沉淀,从而促进氢氧化镁的溶解平衡正向移动,最终氢氧化镁转化为氢氧化铁沉淀,正确;B、草酸是弱酸,不能拆开,错误;C、向硫酸氢钠溶液中加入氢氧化钡溶液使溶液呈中性时,则氢离子与氢氧根离子恰好完全反应,氢氧化钡电离产生2个氢氧根离子,需要2个氢离子与其反应,所以离子方程式中氢离子的系数是2,错误;D、根据酸的电离常数可知HClO酸性大于HCO3-,所以向次氯酸钠溶液中通入少量的二氧化碳,也只能生成碳酸氢钠,不会生成碳酸钠,因为HClO酸性大于HCO3-,错误,答案选A。
考点:考查离子方程式酸性正误的判断
本题难度:困难
4、选择题 下列离子方程式书写正确的是
A.氢氧化铝溶于氢氧化钠溶液: Al(OH)3+3OH- = AlO2- + 3H2O
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH-
参考答案:
本题解析:
本题难度:一般
5、选择题 下列离子方程式正确的是 ( )
A.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2
B.往硝酸银溶液中滴加少量氨水:Ag++2NH3===[Ag(NH3)2]+
C.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO+Ba2++2OH-===BaCO3↓+2H2O+CO
D.石灰石溶于醋酸:CaCO3+2CH3COOH===2CH3COO-+Ca2++CO2↑+H2O
参考答案:D
本题解析:
正确答案:D
A.不正确,Fe(NO3)3溶液中加入过量的HI溶液:8H++2NO3
本题难度:一般