时间:2021-06-11 06:00:09
1、填空题 现有含NH4+、H+、Al3+、Mg2+、Cl-的溶液100mL,往其中逐滴加入2mol/L的氢氧化钠溶液,并不断搅拌,所得沉淀质量与所加氢氧化钠溶液体积的关系如下图,其中OA段无气体产生,回答下列问题。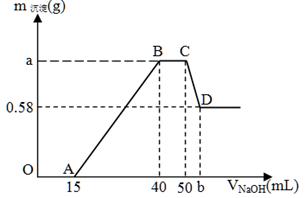
(1)写出下列过程发生反应的离子方程式。
OA段: ;
CD段: ;
(2)氢氧化镁沉淀的质量m[Mg(OH)2] = g。
(3)a = ;b = 。
(4)原溶液中c(NH4+) = ;c(Cl-) = 。
参考答案:(16分)
(1)H+ + OH- = H2O(3分);Al(OH)3 + OH- = [Al(OH)4]-(3分)
(2)0.58(2分)
(3)1.36(2分);55(2分)
(4)0.2mol/L(2分);1mol/L(2分)
本题解析:(1)OA段无气体产生,说明是H+和OH-的反应,离子方程式为H+ + OH- = H2O。
CD段是沉淀溶解的过程,Al(OH)3是和OH-反应,离子方程式为Al(OH)3 + OH- = [Al(OH)4]-。
(2)最终沉淀的物质是氢氧化镁沉淀,根据图中信息可得其质量等于0.58g。
(3)V(NaOH)=25mL,n(NaOH)=0.05mol,AB段,生成的沉淀是Al(OH)3和Mg(OH)2,m[Mg(OH)2] =0.58g,Mg(OH)2中的n(OH-)=0.02mol,则Al(OH)3中的n(OH-)=0.05mol-0.02mol=0.03mol,即m[Al(OH)3]=0.78g,故总质量=0.58g+0.78g=1.36g,即a=1.36g。Al(OH)3 + OH- = [Al(OH)4]-,n[Al(OH)3]=0.01mol,消耗NaOH为0.01mol,体积为0.005L,即5ml,故b=50+5=55。
(4)BC段NH4+和OH-的反应,反应的n(OH-)=0.02mol,NH4++OH-=NH3·H2O,n(NH4+)=0.02mol,c(NH4+) =0.2mol/L。当 V(NaOH)=50mL时溶质为NaCl,n(Cl-)= n(Na+)=0.1mol,即c(Cl-) =1mol/L。
考点:离子方程式的有关计算
点评:本题考查学生利用图象及离子反应来计算,明确图象中每一段曲线对应的化学反应是解答本题的关键,然后利用离子反应计算即可解答,B项是解答的难点。
本题难度:一般
2、填空题 现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下: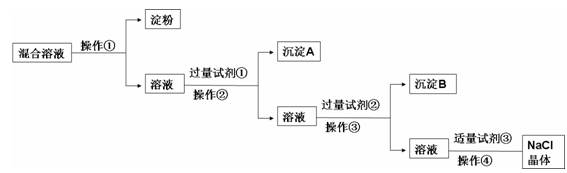
(1)a.操作①是利用胶体中胶体粒子______________(填“能”或“不能”)透过半透膜,溶液溶质分子、离子__________(填“能”或“不能”)透过半透膜进行分离提纯。
b.如何用实验证明淀粉未透过半透膜而Cl-已透过半透膜:
______________________________________________________
_____________ ______
(2)写出上述实验过程中所用试剂:
试剂①_______________________;试剂③________________________。
(3)判断试剂①已过量的方法是:________________________________________。
(4)用化学方程式表示加入试剂②的作用:
________________________________________________________ ____________
(5)操作④的名称是__________________________。
参考答案:(1)a.不能; 能;
b.用两支试管分别取半透膜外的溶液,往其中一支试管滴加AgNO3溶液,产生白色沉淀,说明Cl-已透过半透膜;往另一支试管滴加碘水,溶液不变蓝,说明淀粉未透过半透膜。
(2)氯化钡溶液;稀盐酸
(3)静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量。
(4)BaCl2+Na2CO3=2NaCl+BaCO3↓ CaCl2+Na2CO3=2NaCl+CaCO3↓
(5)蒸发(结晶)
本题解析:略
本题难度:一般
3、填空题 (11分)过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等。试回答下列问题:
(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:____________。
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。则上述最适合的过氧化物是________。
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%-70%的过氧化氢溶液中,则该反应的化学方程式为________,过氧化氢比理论用量稍多,其目的是________。反应温度最好控制在30 -70℃,温度不易过高,其主要原因是________。
(4)下图是硼氢化钠一过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。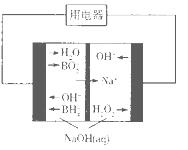
(5)Na2CO3·xH2O2可消毒、漂白。现称取100 g的Na2CO3·xH2O2晶体加热,实验结果如图所示,则该晶体的组成为________。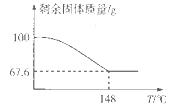
参考答案:(1)H2O2+2H++2Fe2+=2Fe3++2H2O(2分)
(2)BaO2(1分)
(3)Ca(OH)2+2HCHO+2H2O2=Ca(HCOO)2+4H2O(2分) 使甲醛充分氧化,提高甲醛的利用率和产品纯度(1分) 防止H2O2分解和甲醛挥发(1分)
(4)增大(2分)
(5)Na2CO3·1.5H2O2(2分)
本题解析:(1)酸性条件下H2O2氧化氯化亚铁生成氯化铁和水,反应的离子方程式为:
H2O2+2H++2Fe2+=2Fe3++2H2O;(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2;(3)氢氧化钙和甲醛溶液依次加入到质量分数为30%-70%的过氧化氢溶液中生成甲酸钙和水,该反应的化学方程式为:Ca(OH)2+2HCHO+2H2O2=Ca(HCOO)2+4H2O;过氧化氢比理论用量稍多,其目的是:使甲醛充分氧化,提高甲醛的利用率和产品纯度,反应温度最好控制在30 -70℃,温度不易过高,其主要原因是:防止H2O2分解和甲醛挥发;(4)该装置为原电池,正极是阳离子流向的一极,即过氧化氢所在的一极,发生还原反应,电极反应式为H2O2+2e-=2OH-,溶液的pH增大;(5)设该晶体的组成为:Na2CO3·xH2O2:2Na2CO3?xH2O2 =2Na2CO3+xO2↑+2xH2O,根据温度和残留固体的相对质量分数示意图,当温度为148℃时,所得固体只有碳酸钠,质量分数为67.6%,所以固体质量减少的百分数为 68x /(212+68x)×100%=1-67.6%,解得x=1.5,则该晶体的组成为Na2CO3·1.5H2O2。
考点:考查氧化还原反应,离子方程式的书写,化学电源和化学式的确定。
本题难度:一般
4、填空题 (15分)在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛。
(1)溴元素在周期表中的位置为 。
(2)下列说法中正确的是 。
A.CCl4和XeF2分子中各原子最外层均满足8e-结构
B.Cl2O5和Cl2O7都是酸性氧化物
C.氟非金属性强于氯,故氢氟酸的酸性强于盐酸
D.F-、Cl-、Br-、I-等离子的还原性逐渐增强
(3)已知:HCl的沸点是
参考答案:
本题解析:
本题难度:困难
5、选择题 下列离子方程式书写正确的是
A.铜和醋酸: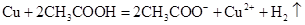
B.氧化铁与稀盐酸: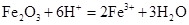
C.铜和硝酸银溶液: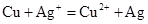
D.稀硝酸和石灰乳: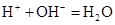
参考答案:B
本题解析:A、铜是不活泼金属,不能和酸反应生成氢气,所以不选A;B、氧化铁和盐酸反应生成氯化铁和水,所以选B;C、没有满足电荷守恒,所以不选C;D、石灰乳不能拆成离子形式,不选D。
考点:离子方程式的判断。
本题难度:一般