时间:2021-06-11 05:46:29
1、选择题 有两种金属组成的合金50克,与足量氯气反应,共用去氯气71克,则该合金不可能的组成是
A.锌和铜
B.锌和铁
C.钙和铜
D.钠和铝
参考答案:AD
本题解析:
本题较难,学生应具有相对较强的数学处理能力。最好解决方法用平均值法。
已知Cl2用71克则有 n(Cl) = 2×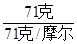 ?=" 2" mol
?=" 2" mol
反应过程中本质有:Cl + e- = Cl-则有n(e-) =" 2" mol
可计算转移每摩尔电子金属质量为: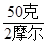 ?=" 25" g/mol?也就是平均数作为判据。
?=" 25" g/mol?也就是平均数作为判据。
Zn 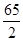 =" 32.5" g/mol? Cu
=" 32.5" g/mol? Cu 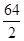 =" 32" g/mol? Fe
=" 32" g/mol? Fe 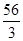 =" 19" g/mol?
=" 19" g/mol?
Ca 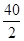 =" 20" g/mol? Na? 23 g/mol? Al
=" 20" g/mol? Na? 23 g/mol? Al 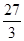 =" 9" g/mol
=" 9" g/mol
可见,不论如何组合;须满足组分一大于 25同时组分二小于25 所以AD不可能出现。
本题难度:一般
2、填空题 铁是一种化学性质比较活泼的金属,也是用途最为广泛的金属之一。铁在一定条件下能跟多种物质发生化学反应。完成下列问题:
(1)以铁为研究对象,仿照下图中的案例在框图处填写物质的化学式(所填写的反应物不属于同一类别的物质,生成物必须填写铁的化合物)。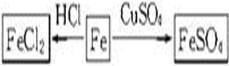
(2)实验室要除去细碎铜屑中的少量铁屑,请用化学方法和物理方法将其除去。(只用简单的原理描述即可)
(3)据统计,每年锈蚀的钢铁约占世界钢铁年产总量的四分之一。联系生活生产实际,举出防止钢铁生锈的两种常用方法:
①__________________________________________________________________。
②__________________________________________________________________。
(4)经研究发现,长期使用铁锅炒菜做饭,可有效地减少缺铁性贫血的发生,原因是______________________;如果在炒菜时经常加入适量的食用醋,效果会更好,理由是_________________________________。
参考答案:(1)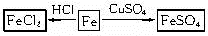
(2)化学方法:加入足量稀盐酸,铁会溶解在稀盐酸中,2HCl+Fe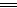 FeCl2+H2↑。物理方法:用磁铁吸引铁屑。(3)①在铁制品表面刷油漆或镀上一层其他金属 ②保持钢铁制品表面的干燥 (4)用铁锅炒菜,会有微量的铁元素进入食物中,可补充人体需要的铁元素 铁能溶解在醋中。
FeCl2+H2↑。物理方法:用磁铁吸引铁屑。(3)①在铁制品表面刷油漆或镀上一层其他金属 ②保持钢铁制品表面的干燥 (4)用铁锅炒菜,会有微量的铁元素进入食物中,可补充人体需要的铁元素 铁能溶解在醋中。
本题解析:铁是一种活泼金属,能与氧气、酸、一些盐反应。本题将铁的性质、用途及其防止铁锈的生成融合在一起,将化学与生活融合在一起,解答要从铁的性质入手,通过性质来分析其用途等。?
本题难度:一般
3、填空题 砖瓦是用含铁元素等杂质的粘土隔绝空气烧制而成的,当烧窑作业临近结束时,若用淋洒水的办法来降低温度,窑内处于还原性气氛,砖块中的铁以氧化亚铁的形式存在,因而砖呈青色.若用捅开窑顶自然冷却的办法,砖就变成了红色.
(1)从化学角度看,砖瓦呈红色的原因是______.
(2)现有一块红砖,实验台上有浓H2SO4、3mol?L-1的盐酸、0.1mol?L-1的KSCN溶液,0.1mol?L-1的FeCl3溶液、0.01mol?L-1的NaOH溶液、蒸馏水等试剂,请选用中学化学常用仪器,设计一个实验,用最简捷的方法验证红砖中含有三价铁.(简述实验步骤,所用仪器、产生现象、所得结论)______.
参考答案:(1)砖瓦是用含铁元素等杂质的粘土隔绝空气烧制而成的,砖瓦呈红色说明铁以红色的氧化铁,捅开窑顶,空气进入窑内,铁元素被氧化生成Fe2O3而呈红色;
故答案为:捅开窑顶,空气进入窑内,铁元素被氧化生成Fe2O3而呈红色;
(2)把红砖磨碎后加入稀盐酸溶解反应后得到的溶液中滴入几滴KSCN溶液,溶液变红色证明Fe3+存在;
故答案为:砸碎红砖,取少量放入研钵内,研成粉末,取该粉末放入试管中,向其中加入3mol?L-1的盐酸,振荡,静置,然后加入几滴KSCN溶液,溶液变红色证明Fe3+存在.
本题解析:
本题难度:一般
4、选择题 将8gFe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为?(?)。
A.1.5mol/L
B.0.5mol/L
C.2mol/L
D.1.2mol/L
参考答案:C
本题解析: 粗看题目,这是一利用关系式进行多步计算的题目,操作起来相当繁琐,但如能仔细阅读题目,挖掘出隐蔽条件,不难发现,反应后只有Na2SO4存在于溶液中,且反应过程中SO42-并无损耗,根据Na+守恒,非常易求得SO42-即原硫酸的物质的量浓度为:2mol/L,故选C。
粗看题目,这是一利用关系式进行多步计算的题目,操作起来相当繁琐,但如能仔细阅读题目,挖掘出隐蔽条件,不难发现,反应后只有Na2SO4存在于溶液中,且反应过程中SO42-并无损耗,根据Na+守恒,非常易求得SO42-即原硫酸的物质的量浓度为:2mol/L,故选C。
本题难度:一般
5、选择题 把铁、铜、FeCl3、FeCl2和CuCl2溶液混在一起,铁有剩余,则溶液中所含最多的阳离子是(?)
A.H+?B. Cu2+?C.Fe3+? D. Fe2+
参考答案:D
本题解析:
正确答案:D
Fe+2Fe3+=3Fe2+? Fe+Cu2+=Fe2++Cu ,所以溶液中最多的阳离子是Fe2+ .
本题难度:简单