时间:2021-02-18 06:12:54
1、选择题 常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是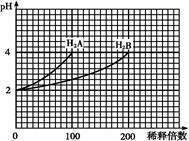
A.H2A为二元强酸
B.pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B)
D.Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+)
参考答案:B
本题解析:A、从图分析,H2A稀释100倍,pH改变了2,说明是强酸,正确,不选A;B、H2A为二元强酸,所以NaHA水溶液中没有HA-和H2A,所以选B;C、H2B稀释100倍,pH变化小,说明是弱酸,所以HB-能电离也能水解,在含NaHA、NaHB的混合溶液中存在物料守恒,c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B),正确,不选C;D、Na2B的水溶液中B2-水解使溶液显碱性,所以正确,不选D。 考点:盐类的水解,溶液的离子浓度的比较,强弱电解质的判断
考点:盐类的水解,溶液的离子浓度的比较,强弱电解质的判断
本题难度:困难
2、选择题 室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是(?)
A.溶液中导电粒子的数目减少
B.溶液中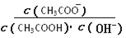 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH<7
参考答案:B
本题解析:A、醋酸是弱电解质,加水稀释,电离平衡正向移动,导致溶液中导电粒子的数目增多,错误;B、温度不变,所以电离平衡常数不变,正确;C、加水稀释,电离平衡正向移动,醋酸的电离程度增大,但氢离子增加的数目不及溶液体积增加的幅度大,所以c(H+)减小,错误;D、若醋酸不稀释,加入10 mL pH=11的NaOH溶液,混合液pH<7,稀释后的溶液的pH不能确定,因为未指明稀释的倍数,错误,答案选B。
本题难度:一般
3、选择题 在0.1mol·L-1的CH3COOH溶液中存在如下电离平衡CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入少量冰醋酸,溶液的pH减小,CH3COOH的电离度增大。
B.滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少。
C.加入少量Na2CO3固体,平衡不移动
D.加水稀释,可使溶液中c(H+)/c(CH3COOH)值增大。
参考答案:D
本题解析:A. 加入少量冰醋酸,浓度由稀变浓,溶液的pH减小,CH3COOH的电离度减小,错误;B. 盐酸中含有氢离子,向醋酸中加入盐酸溶液,氢离子浓度增大,错误;C、加入碳酸钠固体,碳酸钠结合了溶液中的氢离子,促进了醋酸的电离,错误;D.c(H+)/c(CH3COOH)="Ka/" c(CH3COO-),加水稀释,c(CH3COO-)降低,可使溶液中c(H+)/c(CH3COOH)值增大,正确;选D。
考点:考查弱电解质的电离。
本题难度:一般
4、简答题 有①Na2CO3溶液;②CH3COONa溶液;③NaOH溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
A.三种溶液pH的大小顺序是③>②>①
B.若将三种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL?0.1mol/L盐酸后,pH最大的是①
D.若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
参考答案:A.等浓度时强碱的pH最大,强碱弱酸盐中对应的酸性越强,水解程度越小,碳酸的酸性小于醋酸的,所以三种溶液pH的大小顺序是③>①>②,故A错误;
B.稀释时强碱的变化程度大,所以三种溶液稀释相同倍数,pH变化最大的是③,故B错误;
C.等体积等浓度混合后,①中溶质为NaHCO3、NaCl,②中溶质为NaCl、CH3COOH,③中溶质为NaCl,HCO3-离子水解显碱性,所以pH最大的是①,故C正确;
D.三种溶液的pH均为9,c(OH-)=10-5mol/L,c(NaOH)=10-5mol/L,但碳酸的酸性小于醋酸的酸性,所以c(Na2CO3)>c(CH3COONa)>10-5mol/L,所以三种溶液的pH均为9,则物质的量浓度的大小顺序是①>②>③,故D错误;
故选C.
本题解析:
本题难度:一般
5、填空题 (1)有等体积、等pH的Ba(OH)2和NH3·H2O两种溶液,用等浓度的盐酸来滴定,恰好中和时,用去酸的体积分别为V1、V2,则有:V1 V2(填“>”、“<”或“=”)
(2)常温下,等体积、等pH的醋酸和硫酸溶液中:c(CH3COO-) c(SO 42-)填
(填“>”、“<”或“=”)
(3)在AgCl悬浊液中加入过量KI溶液,白色沉淀转化为黄色沉淀。加入过量KI溶液充分反应后,溶液中Ksp(AgCl) (填“增大”、“减小”或“不变”)
(4)在0.10mol·L-1氨水中,加入少量NH4Cl晶体后,则 NH3·H2O的电离程度 (填“增大”、“减小”或“不变”)
参考答案:(1) < (2) > (3) 不变 (4)减小
本题解析:(1)由于氨水是弱电解质,所以在PH值相同的情况下。氨水消耗酸的体积比较大。(2)由于醋酸是属于弱酸,所以在PH值相同的情况下,醋酸的浓度大于硫酸。(3)溶解平 衡常数只与温度有关。所以Ksp(AgCl)不变。(4)加入氯化铵之后,铵根离子增加。反应向氨水的电离的反方向移动,所以氨水的电离程度减小
考点:考查弱电解质的相关知识点
本题难度:一般