时间:2021-02-18 06:12:54
1、选择题 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中不正确的是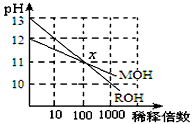
[? ]
A.稀释前,c(ROH) =10 c(MOH)
B.在x点,c(M+) = c(R+)
C.在x点,ROH完全电离
D.MOH是一种弱碱
参考答案:A
本题解析:
本题难度:一般
2、选择题 向0.1 mol/L的氨水溶液中加水稀释或加入少量NH4Cl固体时均会引起变化的是
[? ]
参考答案:B
本题解析:
本题难度:一般
3、简答题 为了证明一水合氨是弱电解质,甲、乙、丙三同学分别选用下列试剂进行实验探究.
可能用到的试剂是:0.10mol?L-1氨水,0.1mol?L-1NH4Cl溶液,NH4Cl晶体,酚酞试剂,pH试纸,蒸馏水等.回答以下问题:
(1)甲用pH试纸测出0.10mol?L-1氨水pH为10,则认定一水合氨是弱电解质,你认为这一方法______(填是、否)正确,说明你的理由是______.
(2)乙取出10mL?0.10mol?L-1?氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b值应满足的关系是______(用等式或不等式表示).
(3)丙取出10mL?0.10mol?L-1?氨水,滴入?2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是______,你认为这一方法______(填能、否)证明一水合氨是弱电解质.
参考答案:(1)如果氨水是强碱,0.10mol?L-1氨水C(H+)=10-140.1mol/L,pH为13,实际上溶液的pH=10<13,所以氨水是弱碱;
故答案为:是,若为强碱,则pH=13;
(2)若是强碱,稀释100倍,pH减小2个单位,由于是弱碱,稀释的过程中,会部分电离,即C(OH-)变化的幅度变小,pH减小幅度小于2个单位,则有a-2<b,且b<a;
故答案为:a-2<b<a;
(3)向氨水中加入氯化铵后,如果氨水是弱电解质,则抑制氨水的电离,溶液中氢氧根离子浓度降低,溶液的碱性减弱,则溶液的颜色变浅,则说明氨水存在电离平衡;
故答案为:溶液颜色变浅,能.
本题解析:
本题难度:一般
4、选择题 下列化学用语的书写正确的是
A.NaH2PO4的水解:H2PO4-+H2O H3O++HPO42-
H3O++HPO42-
B.H2S在水中的电离: H2S 2H++S2-
2H++S2-
C.Na2SO3的水解:SO32-+H2O  HSO3-+OH-
HSO3-+OH-
D.CH3COONa在水中的电离:CH3COONa  CH3COO- +Na+
CH3COO- +Na+
参考答案:C
本题解析:A、NaH2PO4的水解:H2PO4-+H2O OH-+H3PO4, A错误; B、H2S在水中的电离要分步电离: H2S
OH-+H3PO4, A错误; B、H2S在水中的电离要分步电离: H2S H++HS-,HS-
H++HS-,HS- H++S2-,B错误;C、Na2SO3的水解:SO32-+H2O
H++S2-,B错误;C、Na2SO3的水解:SO32-+H2O  HSO3-+OH-,C正确;D、CH3COONa在水中的电离:CH3COONa =CH3COO- +Na+,D错误;答案选C。
HSO3-+OH-,C正确;D、CH3COONa在水中的电离:CH3COONa =CH3COO- +Na+,D错误;答案选C。
考点:考查盐类水解与电离方程式。
本题难度:一般
5、选择题 常温下,将0.1 mo1·L一1的醋酸溶液加水稀释至原来体积的10倍,下列有关叙述正确的是
A.CH3 COOH的电离平衡常数增大为原来的10倍
B.CH3 COO一与CH3 COOH的浓度之比增大为原来的10倍
C.CH3 COO一与H十的浓度之积减小为原来的0.1
D.CH3 COOH与CH3 COO—的浓度之和减小为原来的0.1
参考答案:D
本题解析:A、醋酸的电离平衡常数只与温度有关,温度不变,醋酸的电离平衡常数不变,故A错误;B、加水稀释醋酸,促进醋酸电离,醋酸跟离子的物质的量增大,醋酸分子的物质的量减小,但醋酸是弱电解质不能完全电离,使CH3 COO一与CH3 COOH的浓度之比小于原来的10倍,故B错误;C、醋酸是弱电解质不能完全电离,稀释后浓度之积小于原来的0.1;D、溶液中CH3COOH与CH3COO—的物质的量的和没有变化,溶液体积增加后浓度之和减小为原来的0.1,故D正确。
本题难度:一般