时间:2021-02-18 06:12:54
1、选择题 下列各碱溶液,当其pH相同时,物质的量浓度最大的是
[? ]
A.KOH
B.NH3·H2O
C.Ba(OH)2
D.NaOH
参考答案:B
本题解析:
本题难度:一般
2、选择题 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(溶液)  H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液:①盐酸②石灰水③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,其中能使指示剂显红色的是( )
A.①④⑤
B.②⑤⑥
C.①④
D.②③⑥
参考答案:C
本题解析:根据方程式可知,要使指示剂显红色,则平衡应该向逆反应方向进行。所以根据方程式可知,增大氢离子浓度可以使平衡向逆反应方向进行,溶液显红色,答案选C。
本题难度:一般
3、选择题 在-50℃时,液氨的电离跟水的电离相似,存在平衡,2NH3(l)?N
参考答案:A、虽然加入NaNH2可使平衡向逆反应方向移动,NH2-的浓度增大,但由水的离子积可知,其大小只与温度有关,与离子浓度无关,故A错误;
B、虽然加入NH4Cl可使平衡向逆反应方向移动,NH4+的浓度增大,但由水的离子积可知,其大小只与温度有关,与离子浓度无关,故B正确;
C、由电离方程式知,NH4+与NH2-的离子平衡浓度相等都为1×10-15mol/L,根据水的离子积得液氨的离子积为K=c(NH2-)c(NH4+)=1×10-30,故C正确;
D、由钠与水反应可推知,2Na+2NH3=2NaNH2+H2↑,故D正确;
故选A.
本题解析:
本题难度:简单
4、填空题 今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:
A.①>②>③ B.①<②<③ C.①=②=③ D.①=③>②
E.①>②=③? F.①<②=③ G.①=②<③ H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是__________。
(2)当它们的物质的量浓度相同时,其pH的关系是__________。
(3)中和等体积、等物质的量浓度的三种酸溶液,需同物质的量浓度的烧碱溶液的体积关系为
__________。
(4)当它们pH相同、体积相同时,同时加入锌,则开始时反应速率大小关系为__________。
(5)将pH相同的三种酸均稀释10倍后,pH关系为__________。
参考答案:(1)A
(2)A
(3)G
(4)C
(5)F
本题解析:
本题难度:一般
5、选择题 下表是不同pH环境时某浓度铬酸(H2CrO4)溶液中,离子浓度(mol/L)与pH的关系,下列说法错误的是
| pH | c(CrO42—) | c(HCrO4—) | c(Cr2O72—) | c(H2CrO4) |
| 4 | 0.0003 | 0.1040 | 0.4480 | 0 |
| 6 | 0.0319 | 0.0999 | 0.4370 | 0 |
| 7 | 0.2745 | 0.0860 | 0.3195 | 0 |
| 9 | 0.9960 | 0.0031 | 0.0004 | 0 |
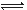 H++HCrO4—
H++HCrO4—参考答案:AC
本题解析:A由表中的数据在PH=4时,c(HCrO4—)= 0.1040可知:铬酸第一级电离方程式为H2CrO4 =H++HCrO4—。错误。B.由表中的数据可知:当PH=9时c(CrO42—)= 0.9960mol/L而c(HCrO4—)、c(Cr2O72—)很小很小。可?见要得到CrO42—应控制溶液的pH>9。正确。C.当电离达到平衡时, v(正)(HCrO4—)= 2v(逆)(Cr2O72—)。错误。D根据Cr守恒可确定c(H2CrO4)= c(CrO42—)+ c(HCrO4—)+2 c(Cr2O72—)= 0.9960+0.0031+0.0004×2=0.9999mol/L.因此该铬酸溶液的物质的量浓度约为1.00mol/L?。正确。2CrO4)溶液中,离子浓度与pH的关系的知识。
本题难度:一般