时间:2021-02-18 05:28:06
1、填空题 (10分)研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。在催化剂作用下,CO可用于合成甲醇:CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
(1)若在恒温恒压的条件下,向密闭容器中充入4 mol CO和8 mol H2,合成甲醇,平衡时CO的转化率与温度、压强的关系如图所示: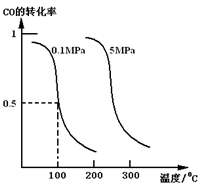
①该反应的正反应属于________反应(填“吸热”或“放热”)。
②在0.1 MPa、100 ℃的条件下,该反应达到平衡时容器内气体的物质的量为_________mol。
(2)若在恒温恒容的条件下,向上述平衡体系中充入4 mol CO,8 mol H2,与(1)相比,达到平衡时CO转化率_______(填“增大”,“不变”或“减小”), 平衡常数K_______(填“增大”,“不变”或“减小”)。
(3)在上述合成甲醇的反应中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH =" +206.2" kJ·mol-1
②CH4(g) + CO2(g) =" 2CO(g)" + 2H2(g) ΔH =" +247.4" kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
2、选择题 N2(g)+3H2(g) 2NH3(g)(正反应放热),在某一时间段中反应速率与反应过程的曲线关系如图。下列说法正确的是
2NH3(g)(正反应放热),在某一时间段中反应速率与反应过程的曲线关系如图。下列说法正确的是 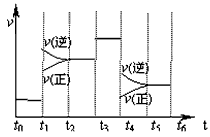
[? ]
A.氨气的体积分数最高的一段时间为t5-t6
B.t2-t3和t3-t4时间段氨气的体积分数相等
C.t1时刻改变的条件是降低温度
D.t4-t5时间段平衡向正反应方向移动
3、填空题 (10分)1000℃时,硫酸钠可与氢气发生反应: Na2SO4(s)+4H2(g)  Na2S(s)+4H2O(g)。请回答下列问题:
Na2S(s)+4H2O(g)。请回答下列问题: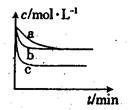
(1)上述反应的平衡常数表达式为: 。
(2)上述反应在三个不同条件下进行,与曲线a比较,b和c分别仅改变一种反应条件,其中H2的浓度随时间的变化如图所示。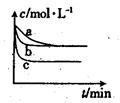
①则曲线b改变的条件为
②该反应的△H___0(填“>”、“<”或“=”)。
(3)该温度下,向2 L盛有1.42 g Na2SO4的密闭恒容容器中通入H2,5 min
后测得固体质量为1.10 g。
①则该时间范围内的平均反应速率v(H2)= 。
②能说明该反应已达到平衡状态的是 (填字母,下同)。
A.容器内压强保持不变
B.容器内气体密度保持不变
C.c(H2)=c(H2O)
D.v正(H2)=v逆(H2O)
4、填空题 工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g) +2H2(g) CH3OH(g) ;△H
CH3OH(g) ;△H
(1)能判断反应达到平衡状态的是____(填字母)。
A.生成CH3OH与消耗H2的速率比为1:2
B.容器内气体密度保持不变
C.容器内气体的平均相对分子质量保持不变
D.容器内各种成分的浓度保持不变
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。 
①由表中数据判断△H____(填“>”“<”或“=”)0;
②某温度下,将2 mol CO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO) =0.2
mol/L,则CO的转化率为____,此时的温度为____
(3)要提高CO的转化率,可以采取的措施是___。
a.升温 b.降温 c.压缩体积加压 d.充入惰性气体加压 e.充入CH3OH加压
f.按n(CO): n(H2)<1:3的比例充入气体加压
g.按n(CO):n(H2)>1:3的比例充入气体加压
h.分离出甲醇
(4)300℃一定压强下,5 mol CO与足量的H2在催化剂作用下恰好完全反应时放出454 kJ的热量。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
下列说法正确的是____。
A.2c1>c3 B.a+b<90. 8 C.2P2<p3 D.α1+α3<1
5、填空题 煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)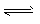 CO2(g)+H2(g)的平衡常数随温度的变化如下表:
CO2(g)+H2(g)的平衡常数随温度的变化如下表: 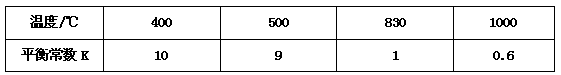
试回答下列问题
(1)上述反应的正反应是_____________ 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率 _________(填“增大”、“减小”或“不变”),容器内混合气体的压强____________ (填“增大”、“减小”或“不变”)。
(3)830℃,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 ________(选填A、B、C、D)。 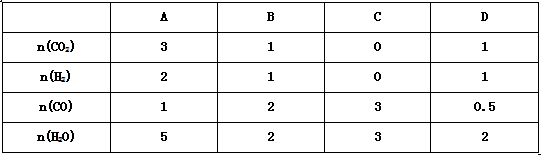
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是________ 。