时间:2021-02-18 05:28:06
1、选择题 已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入体积为1?L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法正确的是?
N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入体积为1?L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法正确的是?
[? ]
A.图中共有两条曲线X和Y,其中曲线y表示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和c
C.反应进行至25?min时,曲线发生变化的原因是加入 0.4mol?N2O4
D.若要达到与d相同的状态,在25?min时还能采取的措施是适当缩小容器体积
参考答案:D
本题解析:
本题难度:一般
2、填空题 将1molCO和1molH2O充入某固定容积的反应器中,在某条件下达到平衡:
CO+H2O(g) CO2+H2,此时有2/3的CO转化为CO2。
CO2+H2,此时有2/3的CO转化为CO2。
(1)该平衡混合物中CO2的体积分数为
(2)若容器体积为1L,到达平衡所需时间为2分钟,则H2的平均反应速率为
(3)若在相同条件下,向容器中充入1molCO2、1molH2和1molH2O,则达到平衡时与⑴中平衡相比较,平衡应向 (填“正反应方向”、“逆反应方向”或“不”)移动,此时平衡混合物中CO2的体积分数可能是下列各值中的
A.22.2%
B.27.55%
C.33.3%
D.36.8%
(4)结合(3)中计算结果分析若平衡向正方向移动时,则下列说法中正确的是( )
①生成物的产量一定增加; ②生成物的体积分数一定增加;
③反应物的转化率一定增大; ④反应物的浓度一定降低;
⑤正反应速率一定大于逆反应速率; ⑥一定使用了催化剂.
参考答案:(1)33.3%;(2分)
(2)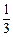 mol/L/min(2分)
mol/L/min(2分)
(3)正反应方向,(2分)B ;(3分)
(4)①⑤(3分)
本题解析:略
本题难度:一般
3、简答题 如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g)?
?xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系.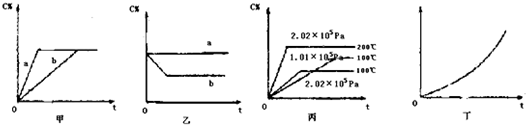
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则______曲线表示无催化剂?(2)若乙图表示反映达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则______曲线表示恒温恒容的情况,此时该恒温恒容中C%______(填变大、表小或不变)
(3)根据丙图可以判断该可逆反应的正反应是______热反应(填放热或吸热),计量数值x的值______;
(4)丁图表示在某固定容器的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度T?的变化情况,根据你的理解,丁图的纵坐标可以是______
①C%?②A的转化率?③B的转化率?④压强?⑤c(A)?⑥c(B)
升温平衡移动的方向为______(填左移或右移)
参考答案:(1)催化剂改变反应历程,提高反应速率,缩短到达平衡的时间,a曲线到达平衡时间短,b曲线到达平衡时间长,所以a曲线表示使用催化剂,b曲线未使用催化剂.
故答案为:b;
(2)恒温恒容下,充入不反应的气体,反应混合物各组分的浓度不变,平衡不移动,反应混合物各组分的含量不变.由图可知,a曲线C的含量不变,b曲线到达新平衡后C的含量降低,所以a曲线表示恒温恒容条件下向平衡混合气体中充入He气,
故答案为:a;不变;
(3)由图可知,压强相同时, 91exam.org温度越高,C的含量越高,即升高温度,平衡向正反应方向移动,升高温度,平衡向吸热方向移动,所以正反应为吸热反应;
温度相同,压强越大,平衡时C的含量越低,即增大压强,平衡向逆反应方向移动,增大压强平衡向体积减小的方向移动,即x>2(x为整数),
故答案为:吸;x>2(x为整数);
(4)该反应正反应为吸热反应,反应前后气体的体积增大.升高温度,平衡向吸热方向移动,即向右移动.
由图可知,纵轴所表示的量随温度升高而增大,升高温度,平衡向吸热方向移动,即向右移动,C的含量增大,A、B的转化率增大,平衡时A、B浓度降低.反应前后气体的体积增大,在恒容条件下,升高温度,平衡向吸热方向移动,即向右移动,混合物总的物质的量增加,所以平衡时,容器内压强增大.故①②③④符合.
故答案为:①②③④;右移.
本题解析:
本题难度:一般
4、选择题 在密闭容器中一定量混合气体发生反应:xA(g) + yB(g) zC(g)平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2mol/l,下列判断正确的是
zC(g)平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2mol/l,下列判断正确的是
[? ]
A.x+y>z
B.平衡向正反应方向移动
C.B的转化率降低
D.C的体积分数保持不变
参考答案:B
本题解析:
本题难度:一般
5、填空题 恒温恒容下,将2mol A气体和2mol B气体通人体积为2 L的密闭容器中发生如下反应:
2A(g)+B(g) xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为
1.2 mo1·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____________。
(2)x=____________。
(3)A的转化率与B的转化率之比为____________。
(4)下列各项可作为该反应达到平衡状态的标志的是____________。
A.压强不再变化
B.气体密度不再变化
C.气体平均相对分于质量不再变化
D.A的消耗速率与B的消耗速率之比为2∶1
(5)保持温度和容积不变,向平衡体系中再充人2molA和2molB气体,达到新平衡时B的物质的量为
____________。
(6)欲使反应达到平衡时,C的物质的量分数与上述平衡相等,起始加入A、B的物质的量n(A)和n(B)之间应满足的关系为____________。
参考答案:(1)0.6 mo1·L-1·min-1
(2)3
(3)2∶1
(4)BC
(5)2.4mo1
(6)n(A)=n(B)或n(A)∶n(B)=1∶1
本题解析:
本题难度:一般