时间:2020-08-23 07:48:03
1、选择题 下列关于化学键的说法中不正确的是( )
A.化学键是一种物质
B.化学键可以使用离子相结合,也可以使原子相结合
C.化学反应中必然有化学键的断裂与形成
D.离子键可以形成离子化合物
2、选择题 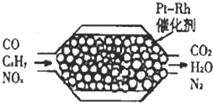 如图表示汽车尾气净化器处理汽车尾气的过程.有关叙述正确的是
如图表示汽车尾气净化器处理汽车尾气的过程.有关叙述正确的是
A.在上述尾气处理过程中,NOx全部被CO还原
B.汽车安装这种净化器后,使用含铅汽油也不会造成铅污染
C.铂(Pt?)和锗(Rh?)都是长周期金属元素,Pt?一Rh催化剂可提高尾气平衡转化率
D.在上述尾气处理过程中,CO和CxHy,均是还原剂
3、选择题 已知:N2+O2 2NO?△H=+180 kJ/mol,其中N≡N,O=O键的键能分别是946 kJ/mol、498 kJ/mol,则NO中化学键的键能为
2NO?△H=+180 kJ/mol,其中N≡N,O=O键的键能分别是946 kJ/mol、498 kJ/mol,则NO中化学键的键能为
A.812 kJ/mol
B.632 kJ/mol
C.1264 kJ/mol
D.1624 kJ/mol
4、填空题 第四周期元素的单质及化合物在工农业生产中应用广泛。
(1)第四周期元素中,基态原子的最外层只有1个电子的元素共有?种。
(2)铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是?(填序号)。
A.氯化钙受热挥发
B.氯化钙受热分解
C.钙离子中电子跃迁
D.氯离子中电子跃迁
(3)无水硫酸铜呈白色,吸水后形成胆矾,呈蓝色。科学家通过X射线测定出胆矾的结构,其结构可用右图表示。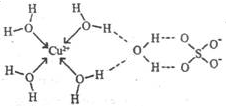
①胆矾晶体中除共价键、配位键及微弱的范德华力外,还存在的两种作用力是?和?。
②胆矾晶体CuSO4·5H2O可以写出[Cu(H2O)4]SO4·H2O,其中中心原子(离子)是?,配体是?,配位原子是?,配位数是?。
③铜离子形成胆矾中配位离子的离子方程式为?。
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如右表。据表判断Mn2+和Fe2+再失去-个电子的难易,并从原子结构的角度筒述其原因?。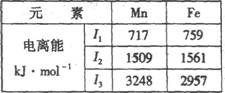
5、选择题 1 mol H—H键的键能是436kJ,1 mol I—I键的键能是151kJ,1 mol H—I键的键能是299kJ,则对反应H2(g)+I2(g)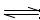 2HI(g)的说法,不正确的是 ( )
2HI(g)的说法,不正确的是 ( )
A.吸热反应
B.放热反应
C.化合反应
D.可逆反应