时间:2020-08-23 07:48:03
1、选择题
A.920 kJ
B.557 kJ
C.436 kJ
D.188 kJ
2、选择题 下列说法正确的是
A.在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ·mol-1
B.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度
C.在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.31 kJ·mol-1。若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
3、选择题 下列各组物质中,全部以共价键结合的是( )
A.Na2S、MgO、HCl
B.NaOH、CaO、N2
C.CO2、H2O、Na2O
D.H2S、NH3、CO2
4、填空题 2SO2(g)+O2 (g)= 2SO3 (g),反应过程的能量变化如图所示。已知:1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ/mol。
请回答下列问题:
(1)图中A、C分别表示?、 ?,E的大小对该反应的反应热有无影响? ?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低??,理由是?;
(2)图中ΔH= ?kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)= ?mol/(L·min);
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程)。
5、填空题 (10分)已知:H2(g)+O2(g)=H2O(g),反应过程中能量变化如图所示: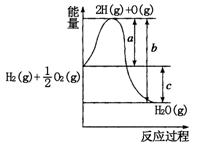
请回答下列问题:
(1)a、b、c分别代表的意义
a. ,
b. ,
c. ;
(2)该反应是 反应(填“放热”或“吸热”),ΔH 0(填“>”、“<”或“=”);
(3)若已知2H2 (g)+O2(g)=2H2O(g) ΔH1=-Q1kJ·mol-1;
2H2 (g)+O2(g)=2H2O(l) ΔH2=-Q2kJ·mol-1,
则ΔH1 ΔH2,Q1 Q2(填“>”“<”或“=”)。