时间:2020-08-23 07:48:03
1、选择题 反应:4A(g)+5B(g)=4C(g)+6D(g)在不同条件下进行,用不同的物质表示其反应速率如下,则此反应在不同条件下进行最快的是
A.v(A)?=2 mol·L-1?·min-1?
B.v(B)?3mol·L-1?·min-1?
C.v(C)?=1 mol·L-1?·min-1?
D.v(D)?=2.4 mol·L-1?·min-1?
2、选择题 下列离子方程式书写正确的是
A.Na2CO3水解:CO+H2O═HCO+OH-
B.NaHS水解:HS-+H2O?S2-+H3O+
C.CuCl2水解:Cu2++2H2O?Cu(OH)2+2H+
D.FeCl3水解:Fe3++3H2O?Fe(OH)3↓+3H+
3、选择题 下列反应的离子方程式正确的是
A.在硫酸溶液中加入氢氧化钡溶液:H++OH-=H2O
B.氨水跟盐酸反应:H++OH-═H2O
C.碳酸钡溶于硝酸:BaCO3+2H+═Ba2++H2O+CO2↑
D.铁和硫酸铜溶液:2Fe+Cu2+=2Fe3++Cu
4、实验题 (9分)某化学兴趣小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是 ,说明反应放热。(下列装置中支撑及捆绑等仪器已略去)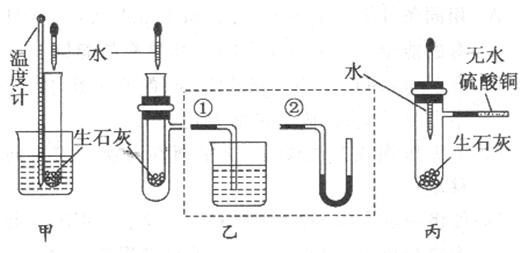
乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是(接①) ,(接②) ,说明反应放热。
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是 ,说明反应放热,其原因是 。
5、选择题 下列物质中,含有非极性共价键的是( )
A.CH4
B.CO2
C.N2
D.NaOH