时间:2020-08-23 06:37:27
1、填空题 (16分)观察下列部分图形,并按要求回答下列问题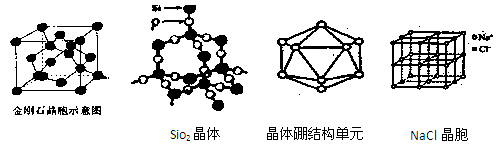
(1)由金刚石晶体结构和晶胞图知,金刚石是原子晶体,晶体中碳原子取?
杂化轨道形成σ键,每个晶胞中含碳原子数为?个。
(2)白磷分子(P4)中键角为?,分子的空间结构为?,每1mol白磷分子含?mol P-P共价键。若将1分子白磷中所有P-P键打开并各插入一个氧原子所得氧化物的分子式为?,若每个P原子的孤对电子再与氧原子配位,就可得到磷的另一种氧化物?(填分子式)。
(3)由SiO2晶体结构知SiO2晶体是?晶体,每1mol SiO2晶体含?mol Si-O共价键。
(4)已知CaC2晶体的晶胞结构与NaCl晶体相似,(如图)但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长,则CaC2晶体中Ca2+配位数(C.N)为?。C22-与O22+互为等电子体,O22+的电子式为?,1molO22+中含π键数目为?。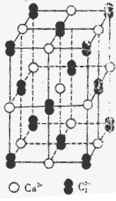
(5)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,观察图形回答。这个基本结构单元由?个硼原子组成,共含有?个B-B键。
(6)若测得mg NaCl固体的体积为Vcm3,已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm,则阿佛加德罗常数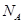 的表达式为?。
的表达式为?。
2、填空题 (1)+3价Co的配合物CoClm·nNH3,中心原子的配位数为6,若1 mol该配合物与足量AgNO3溶液反应生成1 mol AgCl沉淀,用配合物形式写出该配合物的化学式?。
(2)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大磁记录性能越好。离子型氧化物MnO2和Fe3O4及Cr2O3中,磁性最大的是___________。
(3)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如下左图),每个碳原子通过 ? 杂化与周围碳原子成键。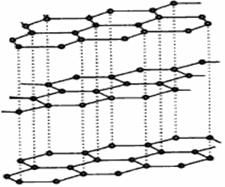 ?
? ?
?
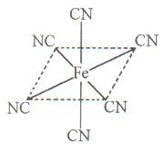
(4)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如上右图。
①已知CN—与N2结构相似,1molCN-中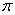 键数目为?。
键数目为?。
②上述沉淀溶解过程的化学方程式为?。
3、填空题 [化学一一选修物质结构与性质](15分)
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示。请回答下列问题。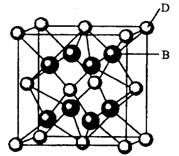
(1)E元素原子基态时的电子排布式为?;
(2)A2F分子中F原子的杂化类型是?,F的氧化物FO3分子空间构型为?;
(3)CA3极易溶于水,其原因主要是? ?,试判断CA3溶于水后,形成CA3·H2O的合理结构?(填字母代号),推理依据是:
?,试判断CA3溶于水后,形成CA3·H2O的合理结构?(填字母代号),推理依据是:
?。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为?;该离子化合物晶体的密度为ag·cm-3。,则晶胞的体积是?(写出表达式即可)。
4、选择题 晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如右图所示,下列说法正确的是 (?)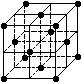
A.C60摩尔质量是720
B.C60属于离子晶体
C.在C60晶胞中有4个C60分子
D.每个C60分子周围与它距离最近等距离的C60分子有12个
5、选择题 β羧乙基锗倍半氧化物(即Ge—132)是与人体健康有关的最重要的有机锗化 合物,其片层结构如右图,每个结构相同的基团都是六个锗原子和六个氧原子构成的十二元环,每个锗原子还同时与三个氧原子相连结,形成可以任意延伸的片层。●代表Ge,○代表O,每个“/”连结一个—CH2—CH2—COOH。在片层结构中,每个正六边形平均拥有的锗原子数与氧原子数各为( )
合物,其片层结构如右图,每个结构相同的基团都是六个锗原子和六个氧原子构成的十二元环,每个锗原子还同时与三个氧原子相连结,形成可以任意延伸的片层。●代表Ge,○代表O,每个“/”连结一个—CH2—CH2—COOH。在片层结构中,每个正六边形平均拥有的锗原子数与氧原子数各为( )
A.6,6
B.2,6
C.2,3
D.2,2