时间:2020-08-23 06:37:27
1、选择题 某离子化合物的晶胞如图所示立体结构,晶胞是整个晶体中最基本的重复单位。阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是? 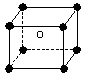
[? ]
A.?1∶8?
B.?1∶4? ?
C.?1∶2?
D.?1∶1
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列有关晶体的叙述中,不正确的是
[? ]
A.金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围紧邻且距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.干冰晶体中,每个CO2分子周嗣紧邻12个CO2分子
参考答案:B
本题解析:
本题难度:简单
3、选择题 构成下列晶体的作用力相同的是(? )
A.氯化钙晶体与石墨晶体
B.常压0 ℃时的三氧化硫、晶体硅
C.干冰、蔗糖
D.固体氮与NaCl晶体
参考答案:C
本题解析:构成晶体的作用力,对于原子晶体是共价键,分子晶体是分子间作用力,离子晶体是离子键。A中氯化钙是离子晶体,石墨是混合型晶体。B中三氧化硫是分子晶体,晶体硅是原子晶体。D中固体氮是分子晶体,NaCl晶体是离子晶体。
本题难度:简单
4、选择题 下列物质的熔、沸点高低顺序正确的是(?)
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4>CBr4>CCl4>CF4
C.K2O>Na2O>O2>N2
D.干冰 >二氧化硅>氯化钠>钠
参考答案:B
本题解析:一般情况下原子晶体的熔沸点最高,其次是离子晶体(或金属晶体),分子晶体的熔沸点最低。A全部是原子晶体,形成原子晶体共价键的原子半径越小,共价键越强,原子半径是Si>C>O,所以应该是金刚石>碳化硅>二氧化硅>晶体硅,A不正确。B中全部是分子晶体,对于组成和结构相似的分子晶体来讲,相对分子质量越大,熔沸点越高,因此B正确。形成离子晶体的离子键越强,熔沸点越高。形成离子键的离子半径越小,所带电荷数越多,离子键越强,所以C中的正确顺序为Na2O> K2O >O2>N2,C错误。D中应为二氧化硅>氯化钠>钠>干冰,所以正确的答案是B。
本题难度:一般
5、选择题 下列叙述正确的是(?)
A.氯化铯晶体中,每1个Cs+与其他8个Cs+等距离紧邻
B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子
C.金属晶体的四种堆积模型中,六方最密堆积和面心立方最密堆积的空间利用率最高
D.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构
参考答案:C
本题解析:氯化铯晶体中,每1个Cs+与其他6个Cs+等距离紧邻,A错误;金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有6个碳原子,B错误; BCl3分子中B原子的最外层没有达到8电子稳定结构,D错误;所以答案选C。
本题难度:一般