时间:2020-08-23 06:23:54
1、选择题 Mg(OH)2在下列四种情况下,其溶解度最大的是
A.在纯水中
B.在0.1 mol·L-1的NH3·H2O溶液中
C.在0.1 mol·L-1的CH3COOH溶液中
D.在0.1 mol·L-1的MgCl2溶液中
参考答案:C
本题解析:由沉淀溶解平衡 Mg(OH)2(s)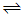 Mg2+(aq)+2OH-(aq)知,A、在纯水中溶解度正常;B、在NH3·H2O溶液中抑制Mg(OH)2溶解,使其溶解度减小;C、在CH3COOH溶液中与OH-反应,促进其溶解;D、在MgCl2溶液中能抑制Mg(OH)2的溶解,比较选项可知C正确。
Mg2+(aq)+2OH-(aq)知,A、在纯水中溶解度正常;B、在NH3·H2O溶液中抑制Mg(OH)2溶解,使其溶解度减小;C、在CH3COOH溶液中与OH-反应,促进其溶解;D、在MgCl2溶液中能抑制Mg(OH)2的溶解,比较选项可知C正确。
考点:沉淀溶解平衡的影响因素。
本题难度:一般
2、选择题 已知下表数据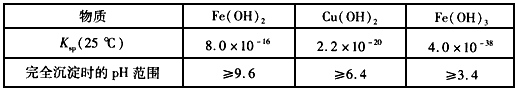
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是
[? ]
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C.向该溶液中加入适量氯水,并调节pH到3.4后过滤,可获得纯净的CuSO4溶液
D.在pH=5的溶液中Fe3+不能大量存在
参考答案:C
本题解析:
本题难度:一般
3、选择题 Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12 ,已知,某溶液中含有C1-, Br- 和CrO42-,浓度均为0.010mo1·L-,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.C1-、Br-、CrO42-
B.CrO42-、Br-、C1-
C.Br-、C1-、CrO42-
D.Br-、CrO42-、C1-
参考答案:C
本题解析:析出沉淀时,AgCl溶液中c(Ag+)= Ksp(AgCl)/ c(Cl-)=(1.56×10-10)/0.01=1.56×10-8mol/L,
AgBr溶液中c(Ag+)= Ksp(AgBr)/ c(Cl-)=(7.7×10-13)/0.01mol/L=7.7×10-11mol/L,Ag2CrO4溶液中c(Ag+)="[" Ksp(Ag2CrO4)/ c(CrO42-)]1/2=[(9.0×10-12)/0.01mol/L]1/2=3×10-5,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Br-、Cl-、CrO42-,选C。
考点:考查沉淀溶解平衡。
本题难度:一般
4、选择题 下列关于难溶电解质溶液说法正确的是 ( )
A.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
B.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl-
D.25 ℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体后,c(Mg2+)增大
参考答案:C D
本题解析:A、在含有BaSO4沉淀的溶液中存在沉淀溶解平衡,溶度积一定温度下是常数,加入Na2SO4固体后硫酸根离子浓度增大,平衡逆向进行,钡离子浓度减小,故A错误;
B、相同温度下,氯化银在水溶液中存在沉淀溶解平衡,依据溶度积是常数,与①蒸馏水相比较,②中0.1 mol·L-1盐酸溶液中氯离子0.1mol·L-1,抑制沉淀溶解平衡,银离子浓度减小;③中0.1 mol·L-1氯化镁溶液中氯离子浓度为0.2mol·L-1,平衡逆向进行,银离子浓度减小;④中0.1 mol?L-1硝酸银溶液中,银离子浓度为0.1mol·L-1,平衡逆向进行,银离子浓度增大,则Ag+浓度:④>①>②>③,故B错误;
C、硫化银溶解度小于氯化银,可以实现沉淀转化,则向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl-,故C正确;
D、氢氧化镁溶液中存在沉淀溶解平衡,氯化铵水解显酸性,与氢氧根离子结合,促进平衡向溶解方向进行,所以镁离子浓度增大,故D正确;
故选CD.
考点:难溶电解质的溶解平衡及沉淀转化
本题难度:一般
5、选择题 下列叙述和推论都正确的是
| | 叙述 | 推论 |
| A | 酸性:HCl >H2CO3>H2SiO3 | 非金属性:Cl >C>Si |
| B | 组成原电池时,通常是还原性较强的物质做负极 | 镁和铝在氢氧化钠溶液中组成原电池时,镁做负极 |
| C | —OH是亲水基,含有—OH的有机物都易溶于水 | 常温时,C2H5OH和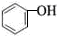 都易溶于水 都易溶于水 |
| D | 溶解度小的沉淀可转化成溶解 度更小的沉淀 | 向AgCl悬浊液中滴加KI溶液可以得到AgI沉淀 |
参考答案:D
本题解析:A、非金属性越强,最高价氧化物水化物的酸性越强,氯元素对应的是高氯酸,盐酸是无氧酸,A错误;B、由于铝能与氢氧化钠溶液反应,所以镁和铝在氢氧化钠溶液中组成原电池时,镁做正极,铝作负极,B错误;C、常温下苯酚难溶于水,C错误;D、根据沉淀转化可知溶解度小的沉淀可转化成溶解度更小的沉淀,碘化银比氯化银更难溶,因此向AgCl悬浊液中滴加KI溶液可以得到AgI沉淀,D正确,答案选D。
考点:考查非金属性、原电池、物质溶解性以及溶解平衡等
本题难度:一般