时间:2020-08-23 06:23:54
1、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
(提示:BaSO4(s) Ba2+(aq)+SO42-(aq)的平衡 常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数)
Ba2+(aq)+SO42-(aq)的平衡 常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数) 
[? ]
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
2、选择题 在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s)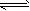 Mg2++2OH-,若使固体Mg(OH)2的量减少,而c(Mg2+)不变,可采取的措施是
Mg2++2OH-,若使固体Mg(OH)2的量减少,而c(Mg2+)不变,可采取的措施是
[? ]
A.加MgCl2
B.加H2O
C.加NaOH
D.加HCl
3、选择题 在一定温度下,氯化银饱和溶液中C(Ag+)·C(Cl-) = Ksp。现将足量AgCl固体分别加入下列物质中,各种溶液中AgCl的溶解度最大的是
A.20ml 0.1mol/LHCl溶液? B.30ml 0.2mol/LHCl溶液
C.40ml蒸馏水? D.50ml 0.05mol/LNaCl溶液
4、填空题 (1)100℃时纯水Kw=1×10-12?mol2?L-2在该温度下,将1mL?0.001mol?L-1的NaOH溶液的pH为______,若加水稀释至100L,则溶液的pH为______.
(2)室温下,pH=1的稀硫酸a?L与pH=12的苛性钠b?L混合后溶液的pH=2,忽略溶液混合前后体积变化,则a:b=______.
(3)已知25℃时100g水中溶有0.74g的Ca(OH)2即达到饱和,则该条件下Ca(OH)2离子积为Ksp=______.
5、选择题 下列说法不正确的是( )
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质,Ksp小的,溶解度一定小